Reaktive Sauerstoffspezies-bezogene Nanopartikel-Toxizität im biomedizinischen Bereich
Zusammenfassung
Die einzigartigen physikalisch-chemischen Eigenschaften von Nanopartikeln haben in letzter Zeit in einer Vielzahl von Anwendungen, insbesondere im biomedizinischen Bereich, zunehmende Aufmerksamkeit gefunden. Es bleiben jedoch Bedenken hinsichtlich der potenziellen toxikologischen Wirkungen von Nanopartikeln, da sie eine höhere Tendenz haben, übermäßige Mengen an reaktiven Sauerstoffspezies (ROS) zu erzeugen. Aufgrund des starken Oxidationspotentials kann der durch Nanopartikel induzierte Überschuss an ROS zur Schädigung von Biomolekülen und Organellenstrukturen führen und zu oxidativer Carbonylierung von Proteinen, Lipidperoxidation, DNA/RNA-Bruch und Zerstörung der Membranstruktur führen, die weiter zu Nekrose, Apoptose, oder sogar Mutagenese. Dieser Aufsatz zielt darauf ab, eine Zusammenfassung der Mechanismen und verantwortlich für die ROS-Erzeugung durch Nanopartikel auf zellulärer Ebene zu geben und Einblicke in die Mechanik der ROS-vermittelten Biotoxizität zu geben. Wir fassen die Literatur zur Toxizität von Nanopartikeln zusammen und schlagen Strategien zur Optimierung von Nanopartikeln für biomedizinische Anwendungen vor.
Einführung
Nanopartikel (NPs) sind eine Klasse neuartiger synthetischer Partikel mit Abmessungen <100 nm. Je nach Form und Größe verleihen die unterschiedlichen physikalischen und chemischen Eigenschaften NPs unterschiedliche Funktionen. Nanopartikel werden in vielen Konsumgütern verwendet, darunter Textilien, Kosmetika, Wasseraufbereitung und Lebensmittelverpackungen [1, 2]. Sie werden auch in der Entwicklung von Photokatalysatoren, Energie und Optoelektronik verwendet [3,4,5,6].
Insbesondere sind NPs zu einem bevorzugten Material in biomedizinischen Materialien geworden und werden häufig in Biosensoren, siRNAs-Transport, gezieltem Gen-Knockdown, Wirkstofftransport und in biofüllenden medizinischen Materialien verwendet [7,8,9,10,11]. Weitere Verwendungen von NPs werden noch entdeckt. Duan et al. [12] zeigte, dass Fe3 O4 -Polyethylenglycol-Polyamid-Amin-Matrix-Metalloproteinase2@ Chlorin e6 (Fe3 O4 -PEG-G5-MMP2@Ce6)-Nanosonden hemmten signifikant das Wachstum von Magentumoren. In einem anderen Fall könnten pDNA-Polyethylenimin-CeO-Nanopartikel (pDNA-PEI-CeO-NPs) mehr Apoptose von Fibrosarkomzellen induzieren [13]. Darüber hinaus konnten hohle Nanopartikel aus Siliciumdioxid-Fe-Polyethylenglycol-humaner epidermaler Wachstumsfaktor-Rezeptor 2 (HS-Fe-PEG-HER2-NPs) selektiv Tumorzellen binden und wurden als bildgebende Mittel verwendet, um normales Gewebe von Krebszellen zu unterscheiden [14]. Schließlich dienen Silber-Nanopartikel (Ag-NPs) als Nano-Antibiotika, die resistente bakterielle Biofilm-assoziierte Infektionen wirksam bekämpfen [15].
Trotz des Potenzials für positive Anwendungen von NPs in verschiedenen Bereichen weisen immer mehr Studien auf deren schädliche Wirkungen auf Organismen [16, 17] und Zellen nach NP-Exposition [18, 19] hin. Das toxische Potenzial von NPs hängt von ihrer Größe und Form ab, was ihre Neigung zur Induktion der Bildung reaktiver Sauerstoffspezies (ROS) bestimmt [20, 21]. Die überschüssige Generation von ROS kann eine Reihe von physiopathologischen Ergebnissen induzieren, einschließlich Genotoxizität, Apoptose, Nekrose, Entzündung, Fibrose, Metaplasie, Hypertrophie und Karzinogenese [18, 22, 23]. Es wurde auch gezeigt, dass die Toxizität von NPs die Expression von proinflammatorischen Zytokinen verstärkt und Entzündungszellen wie Makrophagen aktiviert, die die Bildung von ROS weiter erhöhen [23, 24]. Es wurde auch gezeigt, dass die erhöhte Bildung von ROS nach Exposition gegenüber NPs die Modulation von Zellfunktionen induziert, mit teilweise tödlichen Folgen [17, 23, 25]. In diesem Review diskutieren wir die Hauptmechanismen, die den durch NPs induzierten ROS-Ausbrüchen zugrunde liegen, analysieren die Hauptgründe für die Zytotoxizität von NPs und fassen die potentiellen pathogenen Wirkungen von NPs zusammen. Unser vorliegender Review liefert überwältigende Beweise dafür, dass die Überproduktion von ROS die Hauptursache für die Biotoxizität von NPs ist. Daher sollte eine neue Forschung darauf abzielen, die Zytotoxizität von NPs zu reduzieren, indem NPs entwickelt werden, die eine niedrige ROS-Produktion induzieren.
Die Anwendung von NPs im biomedizinischen Bereich
NPs wurden in einer Vielzahl von medizinischen Anwendungen verwendet, und mehrere neuartige NPs weisen Eigenschaften auf, die für ihre Verwendung in neuartigen biomedizinischen Materialien vielversprechend sind. Wie in Tabelle 1 zusammengefasst, kann Nano-C60 als Antikrebsmittel verwendet werden, das die Proliferation von Krebszellen sowohl in vivo als auch in vitro hemmt [26]. ZnO-NPs wurden als Füllstoffe in orthopädischen und dentalen Implantaten verwendet [38]. TiO2 kann als antibakterielles Mittel, zur Luft- und Wasserreinigung sowie für Zahnersatz verwendet werden [52,53,54]. Davaeifar et al. berichteten, dass ein Phycocyanin-ZnO-Nanostäbchen die Zelle schützen könnte, indem es die endogene ROS-Bildung verringert [68]. Pacurariet al. wiesen darauf hin, dass SWCNTs als klinisches Diagnostikum und als biotechnologische Materialien eingesetzt werden könnten [88]. Darüber hinaus können zahlreiche NPs als antimikrobielle Wirkstoffe verwendet werden, die Bakterien abtöten, indem sie ROS-Bursts auslösen (Tabelle 1).
Die Mechanismen des durch NPs in Zellen induzierten erhöhten ROS
ROS sind chemisch reaktive Partikel, die Sauerstoff enthalten, einschließlich Wasserstoffperoxid (H2 O2 ), reaktive Superoxidanionenradikale (O 2- ) und Hydroxylradikale (•OH) [92, 93]. ROS werden überwiegend in Organellen wie dem endoplasmatischen Retikulum (ER), in Peroxisomen und vor allem in den Mitochondrien erzeugt [94]. Bei der oxidativen Phosphorylierung wird Sauerstoff für die Synthese von Wasser verwendet, indem Elektronen durch die mitochondriale Elektronentransportkette (ETC) hinzugefügt werden. Einige dieser Elektronen werden von molekularem Sauerstoff aufgenommen, um O 2- . zu bilden , die H2 . weiter transformieren kann O2 und •OH [93].
Im physiologischen Kontext werden ROS als natürliche Reaktion auf den normalen Sauerstoffstoffwechsel produziert [95] und spielen eine wichtige Rolle in verschiedenen zellulären Signalwegen [96, 97]. Dröge und Holmstrom et al. berichteten, dass ROS zahlreiche Signalkaskaden aktivieren könnte, darunter den epidermalen Wachstumsfaktor (EGF)-Rezeptor, die Mitogen-aktivierten Proteinkinase (MAPK)-Kaskaden, das Transkriptionsfaktor-Aktivatorprotein-1 (AP-1) und den Kernfaktor-KB ( NF-κB) und beteiligte sich ferner am Prozess des Wachstums, der Proliferation und der Differenzierung von Säugetieren [98, 99]. Weitere Studien zeigten, dass ROS auch die Wundheilung [100], das Überleben nach Hypoxie [101], die intrazelluläre pH-Homöostase [102] und die angeborene Immunität [103] regulierte.
Dennoch kann die intrazelluläre Bildung von ROS nach Exposition gegenüber NPs stark ansteigen, indem ROS-Bursts in Zellen induziert werden [20] (Tabelle 1). Die wichtigsten mechanistischen Erklärungen für ROS-Ausbrüche sind, dass von NPs freigesetzte Metallionen die ROS-Überexpression fördern, indem sie die mitochondriale Atmung beeinträchtigen [30, 104].
Die von NPs freigesetzten Metallionen mischen sich nachweislich in Redoxzyklen und Chemokatalyse über die Fenton-Reaktion [H2 O2 + Fe 2+ → Fe 3+ + HO − + •OH] oder Fenton-ähnliche Reaktion [Ag + H2 O2 +H + =Ag + + •OH + H2 O] [23, 105, 106]. Das dissoziierte Metallion (d. h. Ag + ) verursacht auch eine Deaktivierung von zellulären Enzymen, eine Zerstörung der Membranstruktur [31, 107], einen gestörten Elektronenshuttle-Prozess [108], verringerte Redoxpotentialspiegel, reduzierte mitochondriale Membranpotentiale (MMP) [109] und verstärkt die Akkumulation von intrazellulären ROS weiter. Es wurde auch berichtet, dass NPs die intrazelluläre ROS-Akkumulation fördern, indem sie den Elektronentransferprozess stören [32, 110], wodurch das NADP + . erhöht wird /NADPH-Verhältnis [30] und störende mitochondriale Funktion [18]. NPs beeinträchtigen außerdem die Expression von Genen, die mit oxidativem Stress in Zusammenhang stehen, wie z. B. soxS , soxR , oxyR , und ahpC [58]; antioxidative Gene wie sod1 und GPX 1 [111, 112]; und das mit der NADPH-Produktion zusammenhängende Gen met9 [30]. Die Instabilität der Expression von oxidativen und antioxidativen Genen, die durch NPs verursacht wird, beschleunigt die intrazelluläre ROS-Akkumulation.
Interessanterweise wurde eine erhöhte ROS-Produktion stark mit bestimmten Größen und Formen von NPs in Verbindung gebracht [113, 114]. Zum Beispiel TiO2 NPs trugen zur intrazellulären ROS-Erzeugung bei, was zu Nukleinsäure- und Proteinschäden führte [10]. Liaoet al. festgestellt, dass 10 nm TiO2 NPs hatten eine höhere Genotoxizität als andere getestete Größen und konnten daher eine stärkere ROS-Erzeugung induzieren [115]. In einem anderen Fall förderten Se-NPs die Produktion von ROS in Zellen, und die Ausbeute an intrazellulärem ROS war stark mit dem Durchmesser der Se-NPs verbunden. In diesem Fall induzierte ein Durchmesser von 81 nm mehr ROS-Produktion als andere getestete Größen [113]. Cho et al. zeigten außerdem, dass die Form von NPs ihre Fähigkeit, die ROS-Produktion zu induzieren, stark beeinflusst. Tagblumen-nachahmende metallische Nanopartikel (D-NP) führen zu einer signifikant höheren Produktion von ROS als Nachtblumen-nachahmende metallische Nanopartikel (N-NP), was zu einer verstärkten zelltötenden Wirkung führt [114] (Abb. 1).
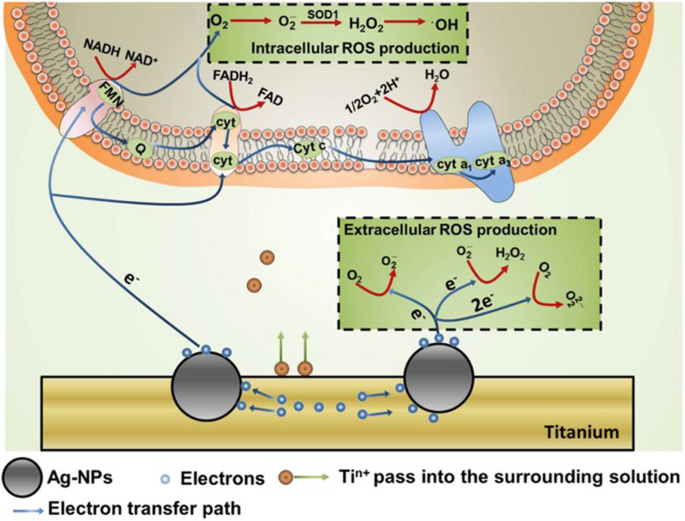
Die Produktion von ROS, die durch NPs in umgebender Lösung und Zellen induziert wird [32]. Die von NPs erzeugten Elektronen könnten in Zellen eindringen und die Funktionen der Atmungskette stören und dann die intrazelluläre ROS-Produktion steigern. Elektronen könnten auch mit O2 . reagieren direkt und erhöht die Erzeugung von extrazellulären ROS
NPs können bei einer sehr geringen Konzentration intrazelluläre ROS-Bursts induzieren (in Tabelle 1 gezeigt), beispielsweise kann Nano-C60 bei 1 μg/ml die Zellapoptose signifikant erhöhen, indem es oxidativen Stress induziert [26, 27]. Bemerkenswerterweise haben die meisten NPs eine dosisabhängige Wirkung, wie für VO2 . berichtet wurde NPs [60, 61] und CuO-NPs [74, 75].
Katastrophale Folgen von NPs auf Zellen durch erhöhte ROS-Produktion
NPs, die in die Zelle gelangen, haben oft nachteilige Auswirkungen auf diese. Die am meisten unterstützte Erklärung für die Zytotoxizität von NPs ist, dass oxidativer Stress durch einen ROS-Burst induziert wird. Durch NPs verursachte ROS-Bursts haben zur oxidativen Modifikation von Biomakromolekülen, zur Schädigung zellulärer Strukturen, zur Entwicklung von Arzneimittelresistenzen, zur Genmutation und zur Karzinogenese geführt [116, 117]. Darüber hinaus haben ROS-Bursts die normalen physiologischen Funktionen von Zellen verändert, wie es bei der Trigger-Inflammation der Fall ist, die letztendlich die Zellfunktionen blockiert und den Organismus schädigt [23, 118, 119]. Im Allgemeinen werden NPs zuerst an der Zelloberfläche adsorbiert und dann durch die Membran in die Zelle geleitet, wo sie die ROS-Erzeugung induzieren [36]. Aufgrund seines starken oxidativen Potenzials belastet ROS die Zelle [46] und greift fast alle Arten von Biomolekülen in der Zelle an, einschließlich Kohlenhydrate, Nukleinsäuren, ungesättigte Fettsäuren, Proteine und Aminosäuren sowie Vitamine [36, 120, 121 ] (Abb. 2).
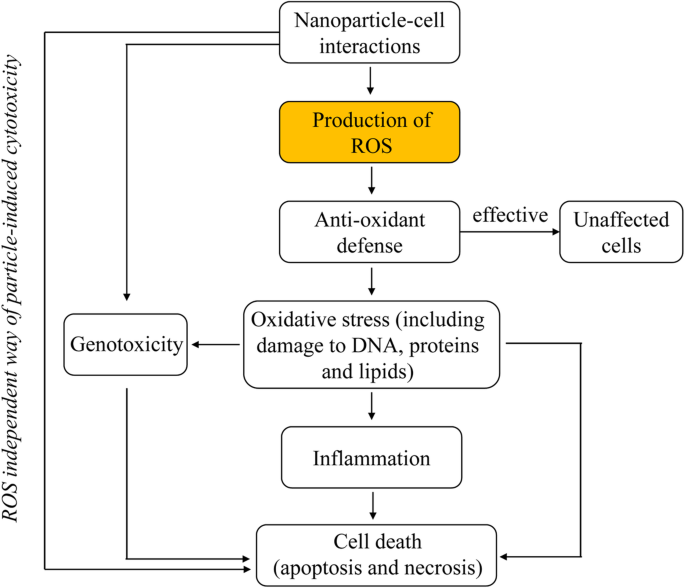
Die entscheidende Rolle von ROS bei der durch NPs induzierten Zytotoxizität [33]. Die möglichen zellulären Ereignisse, die stattfinden, nachdem NPs mit intrazellulären Systemen interagieren
ROS-Ergebnisse in Lipidperoxidat- und Membranstrukturschäden
Lipide, insbesondere ungesättigte Fettsäuren, sind wichtige intrazelluläre Makromoleküle, die eine Schlüsselrolle für den Aufbau und die Funktion der Zellmembran spielen. NPs werden stark von der Zellmembran angezogen, wo sie ROS erzeugen und zur Lipidperoxidation der äußeren Membran führen können. Der veränderte Fettsäuregehalt der Zellmembran kann zu einer erhöhten Zellpermeabilität führen, was zu einem unkontrollierten Transport von NPs aus der extrazellulären Umgebung in das Zytoplasma führt, wo die Zellschädigung weiter fortschreiten kann [76, 122].
Intrazelluläre NPs induzieren die nächste Runde von ROS-Bursts. Überlastete ROS führen zum Aufbrechen der Membranen von Organellen, zum Austritt des Organelleninhalts [52, 123], zur Inaktivierung von Zellrezeptoren [124], zur Freisetzung von Laktatdehydrogenase (LDH) und weiteren irreversiblen Zellschäden [125 ].
ROS greift Proteine an und führt zu einer funktionellen Inaktivierung
ROS greift die hydrophoben Reste von Aminosäuren an, trägt zum Aufbrechen von Peptidbindungen bei und stört die Funktion dieser Proteine [126,127,128]. Carbonylierung ist ein weiteres Merkmal von Proteinen, die oxidativen Schäden ausgesetzt sind [129]. Carbonylierte Proteine bilden chemisch irreversible Aggregate, die nicht über Proteasomen abgebaut werden können, was zu einem dauerhaften Funktionsverlust dieser Proteine führt [130, 131]. Gurunathanet al. [132] zeigten, dass PtNPs die Bildung von ROS steigern und den Gehalt an carbonylierten Proteinen erhöhen können, was die Proliferation von Osteosarkomen hemmt und zur Apoptose beiträgt. In einem Fall hatten sich durch Verbrennung und Reibung abgeleitete Nanopartikel (CFDNPs) im Gehirn junger Erwachsener mit Alzheimer-Krankheit angesammelt, was wahrscheinlich die ROS-Erzeugung förderte, was zu Proteinfehlfaltung, Aggregation und Flimmern führte [133]. Darüber hinaus haben Pelgrift et al. zeigten, dass Mg-NPs die Gentranskription hemmen oder Proteine direkt schädigen können [10].
ROS-induzierte Genmutation
Nukleinsäuren, einschließlich DNA und RNA, sind für die Zellfunktion, das Wachstum und die Entwicklung essentiell, und ihre Nukleotidebestandteile sind anfällige Ziele von ROS [134, 135, 136]. Aufgrund ihres geringen Redoxpotentials können ROS direkt mit Nukleobasen reagieren und diese modifizieren [137]. ROS könnte beispielsweise Guanin zu 8-Oxo-7,8-Dihydroguanin (8-oxoG) [138] und Adenin zu 1,2-Dihydro-2-oxoadenin (2-oxoA) [139] oxidieren. Diese Basenmodifikationen führen zu DNA-Schäden [140]. Aufgrund ihres genotoxischen Potenzials und ihrer Fähigkeit, die ROS-Bildung zu induzieren [141], induzieren NPs signifikant Einzel- und Doppelstrang-DNA-Brüche [142, 143], Chromosomenschäden und aneuploide genetische Ereignisse [144].
Die erhöhte Produktion von ROS ist die Hauptursache für die Fehlcodierung von Genen, Aneuploidie, Polyploidie und die Aktivierung der Mutagenese in Zellen, die NPs ausgesetzt waren [145,146,147,148]. Unter den Nukleotidpools ist Guanin am anfälligsten und wird durch ROS leicht zu 8-oxoG oxidiert [149]. Der erhöhte 8-Oxo-dG-Spiegel in der DNA führt zu einer Fehlpaarung der DNA-Basen [150]. In ähnlicher Weise verursacht der Einbau von A:8-oxoG eine erhöhte Rate von G:C> T:A schädlichen Transversionsmutationen [151, 152]. Das Verhältnis von G:C> T:A-Transversion zu G:C> A:T-Übergangsmutation wurde auch als Index verwendet, um den oxidativen DNA-Schaden zu quantifizieren [153].
Die durch NPs induzierte Erzeugung von ROS führte zur Akkumulation von DNA-Schäden, die die Entwicklung von Mutagenität [154], Onkogenese [155], Multidrug-Resistenz [156, 157], Alterung und Immunflucht [158] vorantreiben. Jinet al. zeigten, dass die Überproduktion von ROS die Mutagenese von DNA-bindenden Transkriptionsregulatorgenen dramatisch erhöht, was zu einem beschleunigten Antibiotika-Efflux führte [159], was wiederum die multiple Antibiotikaresistenz von Bakterien fördert [34]. Giannoniet al. berichteten, dass mitochondriale DNA-Mutationen mit zunehmendem intrazellulärem ROS auftraten und die Aktivität des ETC-Komplexes I weiter schädigten und zu einer mitochondrialen Dysfunktion führten [160, 161].
Es wurde gezeigt, dass durch NPs induzierte DNA-Schäden die Aminosäuresynthese und -replikation hemmen [162] und die aberrante Akkumulation von p53-[163] und Rab51-Proteinen [82, 142] verursachen. DNA-Schäden können auch die Zelle verzögern oder vollständig zum Stillstand bringen [164]. Zellen mit beschädigter DNA verlieren die Fähigkeit zum Wachstum und zur Proliferation [165] und können schließlich zum Zelltod führen [166] (Abb. 3).
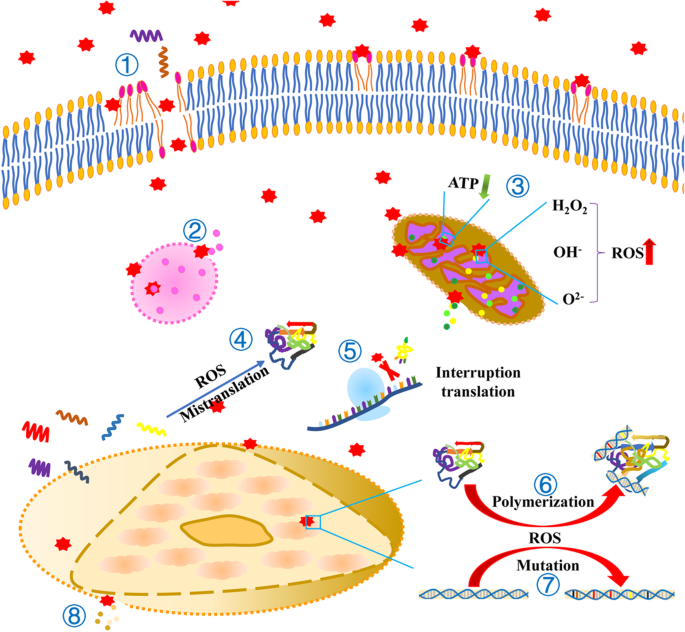
Durch NPs induzierte zelluläre Ereignisse. ① NPs tragen zur Zerstörung der Zellmembran und zur Lipidperoxidation bei. ② Die lysosomale Membran wird durch NPs zerstört und führt zur Freisetzung ihres Inhalts. ③ Die mitochondriale Membran wird durch NPs beschädigt, was zur Freisetzung von Inhalten führt. NPs reduzieren die Bildung von ATP und erhöhen die Produktion von ROS. ④ Die durch NPs induzierte ROS führt zur Fehltranslation von RNA. ⑤ NPs verhindern die Bindung von tRNA an das Ribosom. ⑥ Die durch NPs induzierten ROS führen zur Polymerisation von Proteinen und DNA. ⑦ Die durch NPs induzierte ROS führt zu DNA-Mutationen ⑧ Die Kernmembran wird durch NPs zerstört, was zur Freisetzung ihres Inhalts führt
Erhöhte Produktion von ROS induziert Zellschäden und das Auftreten von Krankheiten
Die Zytotoxizität von NP ist mit oxidativem Stress, endogener ROS-Produktion und der Erschöpfung der intrazellulären Antioxidantien-Pools verbunden. Der erhöhte oxidative Stress führt zu oxidativen Schäden an Biomakromolekülen, die die normale Funktion der Zelle weiter beeinträchtigen und zum Auftreten und zur Entwicklung verschiedener Krankheiten beitragen [167].
NPs induzieren Membranschäden und verbessern den Transport von NPs in das Zytoplasma. NPs konzentrieren sich in Lysosomen, Mitochondrien und im Zellkern, was katastrophale Folgen für die Zelle hat [168, 169]. Es wurde berichtet, dass NPs die Bildung von Adenosintriphosphat (ATP) reduzieren können [89], Glutathion abbauen, Proteinfehltranslationen induzieren [170], Lysosomen aufbrechen [171] und die ribosomale Untereinheit daran hindern können, Transfer-RNA (tRNA) zu binden. Diese zellulären Ereignisse weisen auf einen Zusammenbruch des grundlegenden biologischen Prozesses in der Zelle hin und führen zu einer signifikanten Abnahme der Zelllebensfähigkeit [47]. Singh und Scherz-Shouval et al. berichteten, dass NPs die Zytoskelettfunktionen stören könnten, indem sie die ROS-Erzeugung induzieren und den Prozess der Autophagie und Apoptose in Zellen aktivieren [89].
NPs gelangen über verschiedene Wege in den Körper, beispielsweise über die Haut, die Lunge oder den Darmtrakt (Abb. 4a) und können verschiedenste toxikologische Wirkungen haben und biologische Reaktionen wie Entzündungen und Immunreaktionen auslösen [172,173,174]. In einem Fall führte die Exposition von Zellen gegenüber Silica-NPs dazu, dass Makrophagen große Mengen an Interleukin-1β (IL-1β) sezernierten, was letztendlich zum Zelltod führte [175]. Gao und Kollegen berichteten, dass die Lungenentzündung bei Mäusen nach Exposition gegenüber Kohlenstoffnanoröhren, die alveoläre Makrophagen aktivieren und eine starke Entzündungsreaktion auslösen könnten, erheblich höher war [176]. In einer anderen Studie erlitten Meerschweinchen, die ZnO-NPs ausgesetzt waren, einen Lungenschaden, der zu einer Abnahme der gesamten Lungenkapazität und der Vitalkapazität führt [177,178,179].
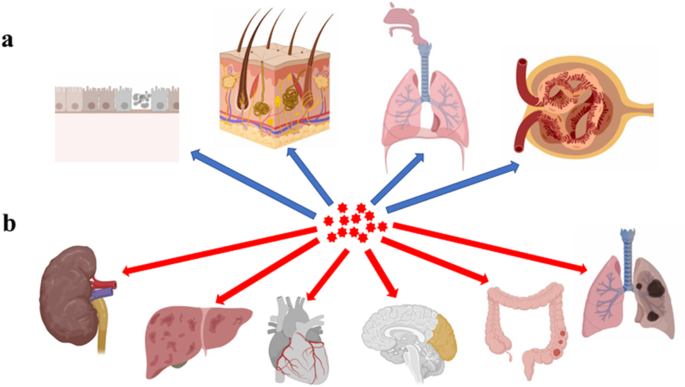
NP Eintritt in und Schädigung von Organen. a NPs könnten über die Mundhöhle, Nasenhöhle, Atemwege, Nieren und den Darmtrakt in die Organismen eindringen; b NPs können sich durch den systemischen Kreislauf ausbreiten und sich in den Nieren, der Leber, dem Herzen, dem Gehirn, dem Darmtrakt und der Lunge ansammeln, was zu Organdysfunktionen führt (Diese Abbildung wurde in BioRender.com erstellt).
ZnO-NPs induzierten auch schwere Verletzungen der Alveolarepithelbarriere und verursachten Entzündungen in der menschlichen Lunge [180]. In einem anderen Fall verursachten im Darm resorbierte NP die Entzündung und den Abbau der Darmschleimhaut [181]. Shubayev et al. stellten fest, dass Mg-NPs die Migration von Makrophagen zum Nervensystem verstärkten, indem sie die Blut-Hirn- und Blut-Nerven-Schranken in einer MMP-abhängigen Weise abbauen [182]. Darüber hinaus zeigten Mäuse, die Kohlenstoff-Nanoröhrchen inhalierten, eine Immunsuppression und eine unterdrückte Antikörperantwort in naiven Milzzellen [183]. Schließlich verursachten Cd-NPs eine starke Abnahme der Lebensfähigkeit der Blutmonozyten, was letztendlich zu einer Immunschwäche führte [184].
Zusätzlich zu den oben genannten Pathologien wurde der stark schwankende ROS-Spiegel als Hauptursache für die Entwicklung zahlreicher menschlicher Krankheiten identifiziert. Tretyakova und Liou et al. zeigten, dass oxidierte DNA dazu neigt, DNA-Protein-Konjugate zu bilden, die sich im Herzen und im Gehirn anreichern und zum Auftreten von Krebs, altersbedingten Erkrankungen und chronischen Entzündungen beitragen [185, 186]. Andersen [187] kam zu dem Schluss, dass Diabetes sowie kardiovaskuläre und neurodegenerative Erkrankungen in hohem Maße mit dem ROS-Ungleichgewicht zusammenhängen. Darüber hinaus haben Pérez-Rosés et al. zeigten, dass ein erhöhter ROS die Entwicklung der Alzheimer- und Parkinson-Krankheit förderte [188].
Es wurde weiter berichtet, dass NPs die Apoptose von Brustkrebszellen fördern [35] und bösartige Gewebe und Krankheitserreger zerstören, indem sie die Bildung von ROS fördern [189, 190]. Es wurde jedoch auch festgestellt, dass ROS die Proliferation sowohl von normalen als auch von Krebszellen induziert, Mutationen stimuliert und in normalen Zellen eine Karzinogenese und in Krebszellen eine Multiarzneimittelresistenz einleitet [191, 192]. Handyet al. fanden heraus, dass Fische, die Kohlenstoffnanoröhren ausgesetzt waren, bei längeren Expositionszeiten Granulome in der Lunge und Tumoren in der Leber aufwiesen [193]. Einige NPs haben multiples Organversagen verursacht, das hauptsächlich Herz, Lunge, Nieren und Leber betrifft. TiO2 Es wurde gezeigt, dass NPs reduziertes Körpergewicht, Milzläsionen, Blutgerinnung in den Atemwegen, Nekrose und Fibrose in Leberzellen und bei Alveolarseptuminkrassation fördern [194, 195]. In einer Studie verhinderten NPs auch die Differenzierung von Stammzellen, was die Organschädigung verschlimmerte [196]. Weitere Forschungen haben auch berichtet, dass NPs die Spermienqualität verringerten [197] und dass die Exposition von Spermien gegenüber Kohlenstoff-NPs ihre Fähigkeit zur Befruchtung von Eiern beeinflusste und die Entwicklung der Embryonen in Purpurseeigeln beeinträchtigte [198]. Immer mehr Beweise zeigen die toxikologischen Wirkungen von NPs auf Mikroorganismen, Algen, Nematoden, Pflanzen, Tiere und insbesondere den Menschen [22, 199, 200] (Abb. 4b).
Der neue NP-Typ mit weniger oder keiner Zytotoxizität
NPs besitzen eine Reihe biomedizinischer Eigenschaften, die sie wertvoll machen (z. B. als antibakterielle und krebsbekämpfende Mittel [26, 27, 28]). Ihr Hauptwirkungsmechanismus ist ihre Fähigkeit, die Produktion von ROS in Zellen zu steigern; diese Eigenschaft macht diese Partikel jedoch auch toxisch, indem sie Genmutation, Apoptose und sogar Karzinogenese verursacht [45, 49, 58]. Folglich besteht ein dringender Bedarf, neue NPs zu entwickeln, die ihre erforderlichen Eigenschaften beibehalten, ohne zu einer übermäßigen ROS-Produktion zu führen. Jüngste Studien haben über neue Arten von NPs berichtet, die intrazelluläre ROS entfernen könnten. Diese Typen fallen in zwei Klassen:(1) NPs, die ROS abfangen können [77] und (2) NPs, die mit zusätzlichen Materialien beschichtet sind, um ihre Zytotoxizität zu verringern [87].
Panikkanvalappil und Kollegen zeigten, dass Pt-NPs den Doppelstrangbruch der DNA hemmen, indem sie ROS abbauen [201]. In einem anderen Fall Mn3 O4 NPs modulierten zelluläres Redox, was zum Schutz von Biomakromolekülen vor oxidativem Stress führte [77]. Darüber hinaus ist das CeO2 NP ist ein neuartiger Wirkstoff, der Zellen und Gewebe mit seiner Fähigkeit zum Abfangen freier Radikale vor oxidativen Schäden schützt [79, 202].
H2 O2 ist das Hauptnebenprodukt von NP-Zell-Interaktionen. H2 O2 zerstört wichtige Biomoleküle wie Proteine, Lipide und Nukleinsäuren. Wurden die Zellen jedoch mit spezialisierten MNPs behandelt, die mit Mercaptopropionsäure (MPA-NPs) oder aminierter Kieselsäure (SiO2 -MNPs) wurden solche Schäden nicht beobachtet [203, 204]. In ähnlicher Weise hat mit Polyvinylpyrrolidon (PVP) beschichtetes GO weniger toxische Wirkungen auf dendritische Zellen (DCs), T-Lymphozyten und Makrophagen als ohne diese Beschichtung. PVP-GO reduziert nachweislich die Apoptose von T-Lymphozyten und steigert sogar die Aktivität von Makrophagen [205]. Pt-beschichtete AuNRs (PtAuNRs) behalten die Wirksamkeit herkömmlicher Gold-Nanostäbchen (AuNR) und können den Zelltod gewünschter Zellen auslösen, während sie das ROS abfangen, wodurch gesunde, unbehandelte Zellen vor dem indirekten Tod durch die ROS-Produktion geschützt werden [87].
Schlussfolgerungen und Ausblick
Nanopartikel mit einzigartigen physikalisch-chemischen Eigenschaften (z. B. ultrakleine Größe, großes Verhältnis von Oberfläche zu Masse und hohe Reaktivität) machen sie für verschiedene Anwendungen äußerst wünschenswert. Technisch hergestellte NPs für kommerzielle Zwecke haben rasch zugenommen. Aus diesem Grund hat die Biosicherheit von NPs in der Öffentlichkeit mehr Aufmerksamkeit gewonnen. In diesem Aufsatz haben wir die Mechanismen und Verantwortlichkeiten für die ROS-Bildung durch NPs auf zellulärer Ebene sowie die jüngsten Fortschritte der ROS-bezogenen NP-Toxizität im biomedizinischen Bereich zusammengefasst und das aufstrebende Gebiet der zellfreundlichen NPs hervorgehoben. Die durch NPs induzierte Erzeugung von ROS im Zusammenhang mit ihrer Größe, Morphologie, Oberfläche und Komponente. Darüber hinaus ist ROS biomultifunktionell in der Zellbiologie und Biomedizin sowie als Schlüsselmediator der zellulären Signalübertragung, einschließlich Zellapoptose, Lebensfähigkeit und Differenzierung.
Um jedoch die Biosicherheit von Nanopartikeln zu verbessern und ihre Verwendung im biomedizinischen Bereich zu beschleunigen, müssen einige Engpässe überwunden werden und es ist noch viel Arbeit erforderlich. Erstens wird erwartet, dass Hochdurchsatzmethoden (HTMs) entwickelt wurden, um die Biotoxizität von NPs in vitro und in vivo effizient nachzuweisen. HTMs könnten Zeit und Ressourcen sparen, mehrere Parameter auf einem einzigen System kombinieren und methodische oder systematische Fehler minimieren. Es würde auch ein tiefes Verständnis der Beziehung zwischen NP-Eigenschaften und Zellantworten bieten, was uns helfen könnte, den optimalen Zustand zu identifizieren.
Zweitens sind die molekularen und zellulären Mechanismen im Zusammenhang mit der Biotoxizität von NP-induzierten ROS noch unklar. Es besteht ein Bedarf, die Mechanismen, die mit der Bildung von ROS durch NPs verbunden sind, weiter zu erforschen, was mehr Informationen liefern würde, um die chemisch-physikalischen Eigenschaften von NPs zu modifizieren, um die ROS-Erzeugung zu kontrollieren. Dies könnte Forschern helfen, neue Strategien zu entwickeln, um die Gefahren von technisch hergestellten NPs zu verringern, um ihre klinische und kommerzielle Übersetzung in das biomedizinische Archiv zu beschleunigen.
Schließlich können NPs aufgrund ihrer strukturellen Eigenschaften über mehrere Wege ungehindert in den Körper gelangen, und die Ansammlung von NPs im Körper kann Entzündungen und Immunreaktionen auslösen, die zu Zellschädigung oder -tod, Organdysfunktion führen und letztendlich das Auftreten von zahlreiche Krankheiten wie Alzheimer, Parkinson, Leberentzündung und Dysembryoplasie. Diese Probleme sind mit der weit verbreiteten Verwendung von NPs dringlicher geworden.
Verfügbarkeit von Daten und Materialien
Alle während dieser Studie generierten oder analysierten Daten sind in diesem veröffentlichten Artikel [und seinen ergänzenden Informationsdateien] enthalten.
Abkürzungen
- •OH:
-
Hydroxylradikal
- 2-oxoA:
-
1,2-Dihydro-2-oxoadenin
- 8-oxoG:
-
8-Oxo-7,8-dihydroguanin
- Ag-NPs:
-
Silbernanopartikel
- AP-1:
-
Transkriptionsfaktor-Aktivatorprotein-1
- ATP:
-
Adenosintriphosphat
- AuNR:
-
Gold-Nanostäbe
- CFDNPs:
-
Von Verbrennung und Reibung abgeleitete Nanopartikel
- DCs:
-
Dendritische Zellen
- D-NP:
-
Tagesblumen imitierende metallische Nanopartikel
- EGF:
-
Epidermaler Wachstumsfaktor
- ER:
-
Endoplasmatisches Retikulum
- ETC:
-
Mitochondriale Elektronentransportkette
- Fe3 O4 -PEG-G5-MMP2@Ce6:
-
Fe3 O4 -Polyethylenglycol-Polyamid-Amin-Matrix-Metalloproteinase2@ Chlorin e6
- H2 O2 :
-
Wasserstoffperoxid
- HS-Fe-PEG-HER2-NPs:
-
Hohle Siliziumdioxid-Fe-Polyethylenglycol-Human-Epidermal-Wachstumsfaktor-Rezeptor 2 Nanopartikel
- LDH:
-
Laktatdehydrogenase
- MMP:
-
Mitochondriale Membranpotentiale
- MPA-NPs:
-
Mit Mercaptopropionsäure beschichtete MNPs
- NADP + /NADPH:
-
Nicotinamidadenindinukleotidphosphat oxidiert/reduziert
- NF-κB:
-
Kernfaktor-κB
- N-NP:
-
Nachtblumen-imitierende metallische Nanopartikel
- NPs:
-
Nanopartikel
- O 2- :
-
Reaktives Superoxid-Anion-Radikal
- pDNA-PEI-CeO-NPs:
-
pDNA-Polyethylenimin-CeO-Nanopartikel
- PtAuNRs:
-
Pt-beschichtete AuNRs
- PVP:
-
Polyvinylpyrrolidon
- ROS:
-
Reaktive Sauerstoffspezies
- SiO2 -MNPs:
-
MNPs mit aminierter Kieselsäure
- tRNA:
-
RNA übertragen
Nanomaterialien
- ROS2 + DDS:Ein Handbuch zur Interoperabilität
- Verwendung von Molybdän im medizinischen Bereich
- Anwendungen von Wolfram im Bereich der Legierungen
- Superleistungen von Diamond im medizinischen Bereich
- IBM &Warwick stellen erstmals hochreaktives dreieckiges Molekül dar
- Die neue Realität des vernetzten Außendienstes
- Unterwegs mit IoT
- Maschinelles Lernen im Feld
- Schnelle Oxidation vs. langsame Oxidation:Was ist der Unterschied?
- Die Vorteile der Sauerstofferzeugung vor Ort



