Eine hochgradig nanoporöse Stickstoff-dotierte Kohlenstoff-Mikrofaser aus Bioressourcen als neue Art von ORR-Elektrokatalysator
Zusammenfassung
Die Synthese von metallfreien Elektrokatalysatoren auf Kohlenstoffbasis für die Sauerstoffreduktionsreaktion (ORR) als Ersatz für konventionelle Platinkatalysatoren ist derzeit ein heißes Forschungsthema. Diese Arbeit schlägt eine aktivierungsunterstützte Carbonisierungsstrategie für die Herstellung von stickstoffdotierten nanoporösen Kohlenstoffmikrofasern (Me-CFZ-900) mit einer hohen BET-Oberfläche (~ 929.4 m 2 .) vor g −1 ) durch die Verwendung von Melamin als Promotor/Stickstoffquelle und Bambus-Kohlenstoff-Bioabfällen als Kohlenstoffquelle mit Hilfe eines Zinkchlorid-Aktivators. Elektrochemische Tests zeigten, dass das Me-CFZ-900-Material eine ausgezeichnete elektrokatalytische ORR-Aktivität und Langzeitstabilität aufweist und auch einen Quasi-Vier-Elektronen-ORR-Weg in alkalischen Elektrolyten aufwies. Wir stellen auch fest, dass das graphitische N das katalytisch aktive Zentrum für die ORR sein kann, aber die Bildung von planarem N kann weiter dazu beitragen, die ORR-Aktivität unserer Katalysatoren zu fördern. Die Ergebnisse eröffnen einen neuen Raum und liefern eine neue Idee zur Herstellung wertvoller poröser Nanokohlenstoffmaterialien auf der Basis von kohlenstoffhaltigen festen Abfällen für die Katalyse einer Vielzahl elektrochemischer Reaktionen in der Zukunft.
Hintergrund
Fortschrittliche elektrochemische Energiesysteme wie Brennstoffzellen und Metall-Luft-Batterien gelten als vielversprechende Alternativen zu traditionellen fossilen Brennstoffen [1, 2]. Die Sauerstoffreduktionsreaktion (ORR) ist eine wichtige Reaktion in diesen Energietechnologien, leidet jedoch unter mehreren Mängeln wie einem hohen Überpotential, einer trägen ORR-Kinetik und einer Pfaddiversität, die die Verbesserung der allgemeinen Leistung und des Umwandlungswirkungsgrads einschränkt [3, 4 ]. Gegenwärtig werden Pt-basierte Katalysatoren häufig eingesetzt, um die ORR in praktischen Anwendungen zu verbessern, aber hohe Kosten und begrenzte Ressourcen an Metall-Pt behindern die Kommerzialisierung [5,6,7]. Daher ist die Erforschung billiger, aktiver und stabiler Pt-freier ORR-Katalysatoren von Bedeutung für die schnelle Entwicklung sauberer Energietechnologien.
Um nach wertvollen Ersatzstoffen für Metall-Pt-Katalysatoren zu suchen, wird die Dotierung von Heteroatomen in Kohlenstoffallotrope wie Graphen [8], Graphdiin [9] und Kohlenstoffnanoröhrchen [10] aufgrund ihrer charakteristischen physikalischen und elektronischen Strukturen allgemein untersucht. Obwohl bei der kontrollierten Herstellung der dotierten Kohlenstoffkatalysatoren eine immense Verbesserung erzielt wurde, ist der Ursprung der katalytischen Aktivität der ORR noch unklar, was auf diesem Gebiet zu einem technischen Engpass wird [11, 12]. Im Allgemeinen kann die Verbesserung der ORR-Aktivität von Katalysatoren mit dotiertem Kohlenstoff einer Ladungsmodulation und einer durch die Heteroatomdotierung im Kohlenstoffgerüst verursachten gebrochenen Elektroneutralität zugeschrieben werden [13, 14]. Andere Untersuchungen zeigten auch, dass die ORR-Aktivität der kohlenstoffbasierten Katalysatoren von einer geeigneten Dotierungsposition und -konfiguration herrührt [15,16,17]. Außerdem kann die Dotierung von Heteroatomen wie Stickstoff eine Polarisation der Kohlenstoffoberfläche induzieren, was zur Bildung neuer stickstoffhaltiger aktiver Zentren beiträgt, wodurch die Adsorption von Atomen und Ionen begünstigt wird [18]. Daher ist es wichtig, den Beitrag N-reicher Kohlenstoffstrukturen zu verstehen, um die katalytisch aktiven ORR-Zentren aufzuklären, was auch einen Weg für das gerichtete Design von ORR-aktiven und stabilen Katalysatoren mit dotiertem Kohlenstoff ebnen kann.
Die Nutzung von natürlicher Biomasse (z. B. Sojabohnen [19], Seidenfibroin [20], Kidneybohnen [21] und Hämoglobin [22]) und tierischen Bioabfällen (z. B. Fischschuppen [23] und Tierblut [24]) als eine direkte Vorstufe oder die Stickstoffquelle von katalytisch ORR-aktiven Zentren wurde als effektiver Weg zur Herstellung der dotierten Kohlenstoffkatalysatoren angesehen. In jüngerer Zeit haben Li et al. synthetisierten auch einen dotierten kohlenstoffbasierten ORR-Katalysator mit einem dreidimensionalen porösen Netzwerk unter Verwendung von Hämin-Biomaterial als Einzelquellen-Vorstufe und Verwendung selbstorganisierter Natriumchlorid-Kristalle als Templat [25]. Jianget al. [26] wandelte das biologische Enzym der Blutzentren in Fe-Nx . um katalytisch aktive Zentren für die ORR-Elektrokatalyse durch die mehrstufige Pyrolyse von Blutbioabfall. Der resultierende Elektrokatalysator zeigt eine überlegene katalytische ORR-Aktivität, was darauf hindeutet, dass die Fe-Nx Die Struktur des Häms in Blutzellen ist für die Bildung aktiver ORR-Zentren von Vorteil und kann daher die Leistung von Katalysatoren fördern. Diese Studien können ein Bestreben sein, eine neue Art von Hochleistungskatalysatoren mit dotiertem Kohlenstoff herzustellen, indem Pyrolyseprozesse entsprechend gesteuert und kostengünstige Biomassematerialien als Vorstufen gewählt werden.
Inspiriert von billigem und leicht erhältlichem heteroatomdotiertem Kohlenstoff aus Bioabfällen für eine überlegene ORR-Leistung entwickeln wir hier eine Strategie zur Synthese einer N-dotierten nanoporösen Kohlenstoffmikrofaser als neuartigen ORR-Elektrokatalysator (Me-CFZ-900) durch Pyrolyse von verschwendetes Bambus-Kohlenstoff-Gewebe durch die Aktivierung von Zinkchlorid, kombiniert mit der Verwendung von Melamin als Promotor/Stickstoffquelle. Nach unserem besten Wissen gibt es bisher keine Berichte über die Gestaltung poröser Kohlenstoff-Mikrofasern als ORR-Katalysator durch die einfache Umwandlung von Bambus-Kohlenstoff-Bioabfällen. Wir stellen fest, dass der hergestellte Me-CFZ-900-Katalysator eine große Anzahl gleichförmiger Mesoporen mit einem durchschnittlichen Porendurchmesser von 2,23 nm und einer großen Oberfläche (~ 929,4 m 2 .) aufweist g −1 ), was für den Massentransport von O2 . von Vorteil sein kann elektrokatalytische Reduktion. Diese Studie eröffnet einen neuen Raum und liefert eine neue Idee zur Herstellung wertvoller poröser Nanokohlenstoffmaterialien, die als vielversprechende ORR-Elektrokatalysatoren fungieren können, indem sie die Poreneigenschaften und den Gehalt an aktiven N-Spezies weiter verbessern.
Methoden
Synthese kohlenstoffbasierter ORR-Katalysatoren
Die stickstoffdotierten nanoporösen Kohlenstoff-Mikrofasern wurden über eine einfache und einfache zweistufige Pyrolyse von Abfall-Bambus-Kohlenstoff-Gewebe (erworben von Fujian Hengan Group Co. Ltd., China) mit Hilfe von Zinkchlorid-Aktivierung hergestellt. Üblicherweise wurden Gewebeabfälle in einem Pulper zerkleinert und dann 1 h bei 350 °C in einem Röhrenofen mit einer Heizrate von 20°C min −1 . karbonisiert unter Stickstoffatmosphäre, um einige restliche organische Substanzen zu entfernen. Die erhaltenen Kohle-Mikrofasern werden als CF350 bezeichnet. Anschließend wurden 0,5 &mgr;g CF350, 1,0 &mgr;g Melamin und 1,0 &mgr;g Zinkchlorid durch einfaches Mahlen im festen Zustand für 0,5 h in einem Achatmörser gleichmäßig gemischt, um einen neuen kohlenstoffhaltigen Vorläufer (Me-CFZ) zu erhalten. Die Me-CFZ-Vorstufe wurde in einem Röhrenofen bei 900°C für 2 h mit einer Aufheizrate von 10 °C min −1 . weiter wärmebehandelt unter der N2 Atmosphäre, was zu einer erfolgreichen Synthese von Me-CFZ-900 führte. Die schematische Darstellung der Synthese von Me-CFZ-900 über ein aktivierungsunterstütztes Carbonisierungsverfahren ist in Abb. 1 dargestellt. Um den Einfluss der Pyrolysetemperaturen auf die ORR-Leistung von kohlenstoffbasierten Katalysatoren zu überprüfen, haben wir auch andere Me-CFZ . hergestellt Katalysatoren bei unterschiedlichen Temperaturen, die als Me-CFZ-700, Me-CFZ-800 bzw. Me-CFZ-1000 bezeichnet werden können. Als Kontrolle wurden CF-900 und CFZ-900 ohne Zugabe von Melamin auf ähnliche Weise hergestellt. Alle Proben wurden durch Eintauchen in eine 0,5 mol l −1 HCl-Lösung für 2 h, bevor sie als ORR-Elektrokatalysator verwendet werden können. Um die Reproduzierbarkeit zu gewährleisten, haben wir alle ORR-Katalysatoren dreimal vorbereitet und ihre Fehler können im Bereich von 5,0% kontrolliert werden.

Die schematische Darstellung zur Synthese mesoporöser stickstoffdotierter Kohlenstoff-Mikrofasern für die ORR-Elektrokatalyse über die aktivierungsunterstützte Karbonisierung von Bambus-Kohlenstoff-Bioabfällen
Physische Charakterisierung
Hochauflösende Rasterelektronenmikroskopie (REM) und Transmissionselektronenmikroskopie (TEM) Tests wurden von Hitachi UHR S4800 (Japan) und FEI Tecnai-G2 F30 Instrument mit einer Beschleunigungsspannung von 300 kV durchgeführt. Röntgenphotoelektronenspektroskopie (XPS) wurde unter Verwendung eines Kratos XSAM800 Spektrometers durchgeführt. Ein Micromeritics Analyzer (ASAP 2010) wurde verwendet, um N2 . zu testen -Adsorptions-/Desorptionsisothermen bei 77 K. Röntgenbeugungsanalyse (XRD) wurde unter Verwendung eines Röntgendiffraktometers Shimadzu XRD-6000 (Japan) mit Cu Ka1 . durchgeführt Strahlung (λ =1.54178 Ǻ) bei 4° min
− 1
. Die Raman-Spektroskopiedaten wurden mit dem Horiba HR800 Raman-System mit einer Laseranregungswellenlänge von 514,5 nm aufgezeichnet. Röntgenaufnahmen wurden mit einem Shimadzu XRD-6000 (λ = Röntgendiffraktometer (Japan) mit Cu Ka1 Strahlung 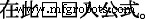 ).
).
Elektrochemische Messungen
Das elektrokatalytische Verhalten des ORR-Katalysators auf Kohlenstoffbasis wurde auf einem CHI760E-Bipotentiostat (Shanghai Chenhua Instruments Co. Ltd., China) bewertet. Eine Glas-Kohlenstoff-Rotations-Ring-Scheiben-Elektrode (GC-RRDE, Φ = 5 mm, Pine Instrument Co.), eine gesättigte Kalomelelektrode (SCE) und einen Graphitstab (Φ = 0,5 cm) wurden als Arbeitselektrode (WE), Referenzelektrode (RE) bzw. Hilfselektrode (AE) verwendet. Die Herstellung von WE bezieht sich auf unsere früheren Berichte [12]. Im Allgemeinen 10 μl von 10 mg ml −1 Dispersion wurde auf die GC-RRDE-Oberfläche pipettiert und natürlich an der Luft getrocknet. Die Massenbeladung von Katalysatoren auf Kohlenstoffbasis und kommerziellem Pt/C-Katalysator (20 Gew.-% Pt, Aladdin Industrial Co. Ltd.) wurde auf ~ 600 μg cm –2 . eingestellt . Alle Potentiale (gegen SCE) wurden in die Potentiale gegen die reversible Wasserstoffelektrode (RHE) umgewandelt. Darüber hinaus wurden elektrochemische Impedanzspektren (EIS) in Gegenwart von 1 mmol l −1 K3 [Fe(CN)6 ]/K4 [Fe(CN)6 ] (Molverhältnis = 1:1) Mischung als Redoxsonde in 0.1 M KCl-Lösung. Um eine während des Tests erzeugte vollständige Peroxidzersetzung ausreichend zu induzieren, wurde das Ringpotential auf 0,5 V (gegen SCE) eingestellt, wie an anderer Stelle berichtet. Die %HO2 − Ausbeute und Elektronentransferzahl (n ) während der ORR wurden mit den folgenden Gleichungen berechnet [25]:
$$ \%{HO}_2^{-}=100\times \frac{2{I}_{\mathrm{r}}/N}{I_{\mathrm{d}}+\left({I} _{\textrm{r}}/N\right)} $$ (1) $$ n=4\times \frac{I_{\textrm{d}}}{I_{\textrm{d}}+{I }_{\mathrm{r}}/N} $$ (2)wo ich d ist der faradaysche Strom an der Scheibe, I r ist der faradaysche Strom am Ring und N ist die Sammeleffizienz der Ringelektrode (0.38). n wurde aus der Koutecky-Levich-Gleichung [27] berechnet:
$$ 1/{j}_d=1/{j}_k+1/B{\omega}^{1/2} $$ (3) $$ B=0,62{nFC}_{\mathrm{O}} {D}_{\mathrm{O}}^{2/3}{\nu}^{-1/6}{\omega}^{1/2} $$ (4)wo F ist die Faraday-Konstante, C O ist die O2 Sättigungskonzentration im Elektrolyten, D O ist die O2 Diffusionskoeffizient im Elektrolyten, ν die kinetische Viskosität des Elektrolyten ist und ω die Rotationsgeschwindigkeit der Elektrode ist und 0,62 eine Konstante ist, wenn die Rotationsrate in U/min ausgedrückt wird.
Ergebnisse und Diskussion
Abbildung 2 zeigt die SEM- und TEM-Bilder des Me-CFZ-900-Katalysators. Wie in diesen REM-Bildern zu sehen ist, besteht der Me-CFZ-900-Katalysator aus unregelmäßigen stickstoffdotierten Kohlenstoffmikrofasern (Abb. 2a, b). Außerdem bestätigen TEM-Bilder von Me-CFZ-900 (Abb. 2c, d) die Ergebnisse der SEM-Analyse weiter. Die Bildung von Mesoporen im Me-CFZ-900-Katalysator wird der Rolle der Zinkchloridaktivierung während der Hochtemperaturpyrolyse zugeschrieben, die eine schnelle Dehydratisierung und katalytische Dehydroxylierung induziert, was zur Freisetzung von Wasserstoff und Sauerstoff in Form von H2 Oh Dampf. Dieser Aktivierungsprozess kann die Herstellung von mehr Mesoporen während des Stickstoff-Dotierungsprozesses innerhalb des Me-CFZ-900-Katalysators erleichtern. Darüber hinaus können dank der N-Dotierung auch einige freiliegende Kantendefekte beobachtet werden, was zur Förderung der katalytischen Aktivität der ORR von Vorteil ist.

Das SEM (a , b ) und TEM (c , d ) Bilder von Me-CFZ-900
Stickstoffadsorptions-/Desorptionsisothermen wurden verwendet, um die spezifische Oberfläche nach Brunauer-Emmett-Teller (BET) und die Porenverteilungseigenschaften zu untersuchen, wie in Abb. 3a und Zusatzdatei 1:Abbildung S1 gezeigt. Es wurde festgestellt, dass eine hohe BET-Oberfläche (~ 929.4 m 2 g −1 ) von Me-CFZ-900 ist auf seine raue defektreiche Oberfläche und mesoporöse Eigenschaften zurückzuführen, die gut mit den Ergebnissen von TEM-Messungen übereinstimmen. Die BJH-Porengrößenverteilung des Me-CFZ-900-Katalysators ist im Einschub von Fig. 3a angegeben. Das Gesamtporenvolumen von Me-CFZ-900 mit einem durchschnittlichen Porendurchmesser von 2,3 nm beträgt ~ 0,53 cm 3 g −1 , aber die Mesoporen konzentrieren sich hauptsächlich auf den Porendurchmesser von 3,88 nm. Diese hervorragenden Eigenschaften können eng mit der Verbesserung der ORR-Aktivität in Verbindung gebracht werden. Die Kohlenstoffstrukturen verschiedener kohlenstoffbasierter ORR-Katalysatoren wurden durch Röntgenbeugungsmuster in Abb. 3b untersucht. Es können keine kristallinen Peaks beobachtet werden, außer zwei Kohlenstoffebenen ((002 ) und (101)), die sich bei ~ 24° bzw. ~ 43° befinden, was auf die amorphe Kohlenstoffstruktur schließen lässt [19, 20]. Der starke (002)-Beugungspeak kann hauptsächlich den Gitterebenen eines typischen turbostratischen Kohlenstoffs zugeschrieben werden [28]. Aufgrund der leichten Verzerrung in kristallinem kann jedoch ein höherer 2-Theta-(002)-Peak und ein niedrigerer 2-Theta-(101)-Peak für Me-CFZ-900 im Vergleich zu denen für CF-900 und CFZ-900 erhalten werden Regelmäßigkeit entlang der a oder b Richtung durch die Dotierung von Stickstoffatomen im sp 2 Kohlenstoffgitter. Außerdem haben alle Raman-Spektren von CF-900, CFZ-900 und Me-CFZ-900 (Abb. 3c) zwei Plattenbanden gezeigt, die sich bei ~ 1345 und ~ 1590 cm −1 . befinden , die dem ungeordneten sp 3 . zugeordnet werden Kohlenstoff (D-Band) und Graphit sp 2 Kohlenstoff (G-Band) bzw. Das Intensitätsverhältnis (I D /Ich G ) von „D“-Band zu „G“-Band wurde verwendet, um die ungeordneten und graphitischen Grade zu charakterisieren. Das entsprechende Ich D /Ich G für CF-900, CFZ-900 und Me-CFZ-900 betragen etwa 0,91, 0,91 bzw. 0,92. Ein höheres Ich D /Ich G Das Verhältnis von Me-CFZ-900 stellt eine höhere Stickstoffdotierungseffizienz und eine stärker defekte Struktur dar, was die Erhöhung der Dichte des aktiven Zentrums und die Verbesserung der elektrokatalytischen ORR-Aktivität erleichtert. In früheren Berichten wurde auch vorgeschlagen, dass die elektrische Leitfähigkeit von Katalysatoren mit dotiertem Kohlenstoff durch die Dotierung von mehr Stickstoffatomen verbessert werden kann [25]. Aus diesem Grund haben wir die elektrische Leitfähigkeit (EC) aller dotierten Kohlenstoffkatalysatoren durch elektrochemische Impedanzspektroskopie (EIS) in 1 mmol l −1 . weiter getestet K3 [Fe(CN)6 ]/K4 [Fe(CN)6 ] (Molverhältnis = 1:1) Sondenlösung, wie in Abb. 3d dargestellt. Die Bode-Ergebnisse beweisen, dass Me-CFZ-900 einen viel geringeren Widerstand für den Massentransport bietet, was auf eine bessere Gesamtleitfähigkeit im Vergleich zu CF-900 und CFZ-900 hindeutet. Darüber hinaus kann eine höhere elektrische Leitfähigkeit von Me-CFZ-900 dazu beitragen, die Elektronentransportkapazität zu fördern, was zu einer besseren ORR-Aktivität im alkalischen Medium führt.
a N2 -Sorptionsisothermen von Me-CFZ-900. b XRD-Muster von CF-900, CFZ-900 und Me-CFZ-900. c Raman-Spektren von CF-900, CFZ-900 und Me-CFZ-900. d Bode-Spektren von CF-900, CFZ-900 und Me-CFZ-900 unter einer Sinuswelle von 5,0 mV Amplitude im Frequenzbereich von 100 kHz bis 10 MHz
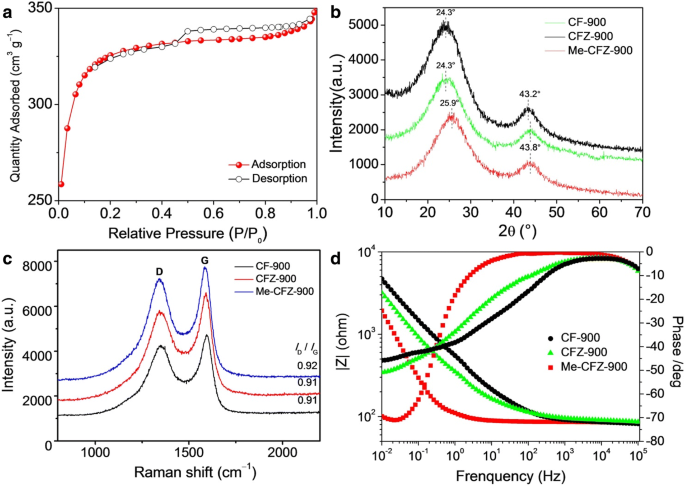
Die XPS-Umfragedaten (siehe Zusätzliche Datei 1:Abbildung S2) zeigen, dass Me-CFZ-900 hauptsächlich aus Stickstoff, Kohlenstoff bzw. Sauerstoff besteht. Das Auftreten des N1s-XPS-Peaks legt die erfolgreiche Dotierung von Stickstoff in die Kohlenstoffstruktur nahe, was durch die Analyse des C1s-Peaks von Me-CFZ-900 hinreichend nachgewiesen wird. Der N1s-Peak von CF-900 und CFZ-900 kann jedoch aufgrund des niedrigen Stickstoffgehalts im Bambus-Kohlenstoff-Bioabfall nicht beobachtet werden, wie in Zusätzliche Datei 1:Abbildung S1 und Tabelle S1 gezeigt. Außerdem wurde der Gesamt-N-Gehalt von drei dotierten N-Katalysatoren durch Oberflächen-XPS-Analyse bestimmt. Der Gesamt-N-Gehalt von Me-CFZ-900 beträgt 2,71 At.%, aber der Gesamt-N-Gehalt beträgt nur 0,91 At.% für CF-900 bzw. 0,94 At.% für CFZ-900. Wir überprüfen weiterhin hochauflösende N1s-XPS-Spektren von CF-900, CFZ-900 und Me-CFZ-900, wie in Abb. 4(a–c) gezeigt. Die N1s-XPS-Spektren von CF-900 und CFZ-900 können in einen Peak mit einer Bindungsenergie (BE) von ~ 401.5 eV entfaltet werden, die der graphitischen N-Spezies entspricht. Das hochauflösende N1s-XPS-Spektrum von Me-CFZ-900 weist jedoch auf die Existenz von vier Arten von Stickstoffgruppen hin:Pyridin-N bei 398,3 eV, Pyrrol-N bei 398,8 eV, Graphit-N bei 401,2 eV und oxidiertes N bei 403,4 eV [29,30,31]. Die Bildung von Pyridin-N und Pyrrol-N stammt aus der thermischen Zersetzung von Melamin während des Aktivierungs-Karbonisierungsprozesses bei hohen Temperaturen. Darüber hinaus können die hochauflösenden C1s-Spektren (Abb. 4d und zusätzliche Datei 1:Abbildung S3) von CF-900, CFZ-900 und Me-CFZ-900 in vier Peaks bei 284,5, 285.9, 287,0 und entfaltet werden 293.0 eV, die dem graphitischen sp 2 . zugeordnet werden Kohlenstoff (C=C), amorpher Kohlenstoff (C–C), sp 2 an Stickstoff gebundene Kohlenstoffatome (C–N) und sp 2 an Sauerstoff gebundene Kohlenstoffatome (C–O) [32], getrennt. Der Anteil der C-N-Struktur steigt von 7,8 at.% für CF-900 auf 12,2 at. % in Me-CFZ-900, was weiter beweist, dass mehr Stickstoffatome erfolgreich in das Kohlenstoffgerüst von Me-CFZ-900 eingebaut wurden. Darüber hinaus zeigen diese Ergebnisse, dass die Zugabe von Melamin als Promotor und Stickstoffquelle während der Pyrolyse bei 900°C den Gesamt- und dotierten N-Gehalt beeinflussen und dann zur Bildung aktiverer Zentren in Me-CFZ-900 beitragen kann, was die um die katalytische Aktivität der ORR bei elektrochemischen Tests zu erhöhen.
Hochauflösende N1s XPS-Spektren von CF-900 (a ), CFZ-900 (b ) und Me-CFZ-900 (c ). (d ) Hochauflösende C1s XPS-Spektren von Me-CFZ-900 (d )
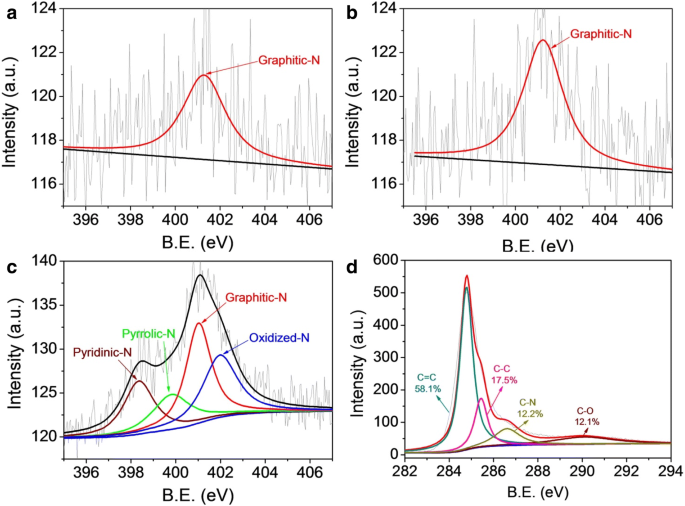
Um die elektrokatalytische Aktivität der ORR zu bewerten, wurden jeweils drei kohlenstoffbasierte ORR-Katalysatoren auf die GC-RRDE-Oberfläche aufgetragen und weiter durch Cyclovoltammetrie (CV) und Linear-Sweep-Voltammetrie (LSV) in O2 . getestet -gesättigt 0.1 mol l −1 KOH-Lösung. Die elektrochemischen Ergebnisse zur ORR-Aktivität sind in Abb. 5a angegeben. Es kann festgestellt werden, dass alle CV-Kurven von CF-900, CFZ-900 und Me-CFZ-900 in O2 -gesättigter Elektrolyt zeigt deutliche ORR-Peaks mit Peakpotentialen von 0,69, 0,84 bzw. 0,91 V gegenüber RHE. Es wurde gefunden, dass die ORR-Aktivität für drei Kohlenstoffkatalysatoren der Reihenfolge Me-CFZ-900 > CFZ-900 > CF-900 folgt. Darüber hinaus wurden in O2 . aufgezeichnete LSV-Kurven (Abb. 5b) -gesättigte KOH-Lösung wurden bei einer Rotationsgeschwindigkeit von 1600 U/min erhalten, um die katalytischen Aktivitäten von CF-900, CFZ-900 und Me-CFZ-900 besser zu verstehen. Die CFZ-900-katalysierte Elektrode zeigt eine bessere ORR-Aktivität bei einem Halbwellenpotential (E 1/2 ) von 0,78 V im Vergleich zur CF-900-katalysierten Elektrode mit einem E 1/2 von 0,65 V gegenüber RHE. Außerdem ein höheres E 1/2 von ~ 0,86 V und eine größere begrenzte Stromdichte bei gegebenen Potentialen kann mit der Me-CFZ-900-katalysierten Elektrode erreicht werden, die mit denen des kommerziellen Pt/C-Katalysators (20 Gew.-%) vergleichbar ist (siehe zusätzliche Datei 1:Abbildung S4) und andere in der Literatur beschriebene Kohlenstoffkatalysatoren (siehe zusätzliche Datei 1:Tabelle S2). Diese Ergebnisse stimmen gut mit den Ergebnissen von CV-Messungen überein und zeigen weiterhin die ausgezeichnete ORR-Aktivität von Me-CFZ-900. Es wird vermutet, dass die Aktivierung von Zinkchlorid und die Zugabe einer Stickstoffquelle die katalytische Aktivität der ORR aufgrund der Bildung mesoporöser Strukturen und der Verbesserung der N-Dotierungseffizienz während des Pyrolyseprozesses verbessern können.
a CV-Kurven von CF-900, CFZ-900 und Me-CFZ-900 in O2 -gesättigt 0.1 mol l −1 KOH-Lösung. b LSV-Kurven für ORR von CF-900, CFZ-900 und Me-CFZ-900 und 20 wt% Pt/C in O2 -gesättigte 0,1 M KOH-Lösung bei einer Rotationsgeschwindigkeit von 1600 U/min. c Scheiben- und Ringströme mit LSV auf RRDE für CF-900, CFZ-900 und Me-CFZ-900 in O2 -gesättigt 0.1 mol l −1 KOH-Lösung. d Die entsprechende Elektronentransferzahl und H2 O2 Ertrag von c
RRDE-Messungen wurden durchgeführt, um Einblicke in die ORR-Kinetik von kohlenstoffbasierten Katalysatoren zu erhalten, wie in Abb. 5c gezeigt. Außerdem wird basierend auf den RRDE-Daten die entsprechende übertragene Elektronenzahl (n ) und Peroxidspezies (H2 .) O2 %), die während der ORR produziert werden, werden über die Gl. (1) bzw. (2). Die Berechnungsergebnisse sind in Abb. 5d dargestellt. Die H2 O2 Ausbeute (< 14.0%) und Elektronentransferzahl (3.45–3.95) auf Me-CFZ-900 liegen im Potentialbereich von 0.2–0.8 V gegen RHE, was auf einen ähnlichen Quasi-Vier-Elektronen-Weg für den ORR-Prozess hinweist zur ORR-Kinetik eines kommerziellen Pt/C-Katalysators (zusätzliche Datei 1:Abbildung S3). Im Vergleich zum Me-CFZ-900, höherer H2 O2 Ausbeute und kleinere Elektronentransferzahl können sowohl bei CF-900 als auch bei CFZ-900 im gleichen Potentialbereich beobachtet werden. Die H2 O2 Die Ausbeute von CFZ-900 ist höher als die von Me-CFZ-900, aber die Elektronentransferzahl von CFZ-900 ist ähnlich der von Me-CFZ-900, was ebenfalls auf einen Quasi-Vier-Elektronen-Weg für den ORR-Prozess hindeutet. Leider weist CF-900 die niedrigste Elektronentransferzahl (2,64–3,56) und die höchste H2 . auf O2 Ausbeute (22.2–68.2%), was darauf hindeutet, dass die durch CF-900 katalysierte ORR hauptsächlich einem gemischten Weg aus Zwei- und Vier-Elektronen-Prozessen folgt. Diese Ergebnisse beweisen, dass die durch die Zinkchloridaktivierung hergestellten Kohlenstoffkatalysatoren mit oder ohne Zusatz von Melamin eine höhere katalytische ORR-Effizienz und elektrokatalytische Leistung gezeigt haben. In Kombination mit XPS-Analyse und ORR-Aktivitätsdaten stellen wir fest, dass in CF-900 und CFZ-900 nur Graphit-N-Spezies vorkommen können, aber eine katalytische ORR-Aktivität aufweisen, was beweist, dass das Graphit-N eines der elektrokatalytisch aktiven Zentren sein kann, die zur Elektrokatalyse der ORR. Es ist bemerkenswert, dass die Zugabe von Melamin in die Vorstufe die Bildung von Pyridin-N- und Pyrrol-N-Spezies mit planaren Strukturen fördern kann, die für die Erhöhung der ORR-Aktivität verantwortlich sein können, gestützt durch die zuvor berichteten Ergebnisse [29]. Außerdem kann die hervorragende ORR-Leistung von Me-CFZ-900 auch anderen Aspekten zugeschrieben werden:(1) Die hohe BET-Oberfläche und die mesoporöse Struktur von Me-CFZ-900 können die Adsorption und den Transport von Sauerstoffmolekülen und die Exposition von mehr . erleichtern aktive Stellen; (2) eine höhere elektrische Leitfähigkeit von Me-CFZ-900 kann den Elektronentransport des ORR-Prozesses effektiv steigern; und (3) mehr N-Atome werden in die Kohlenstoffstruktur von Me-CFZ-900 eingebaut, was stickstoffreichere defekte Strukturen und aktive Zentren erzeugen kann. Daher ist die kontrollierte Synthese von hohen Gehalten an planaren und graphitischen Stickstoffspezies für die Herstellung von Aktivkohle-Katalysatoren für die ORR unerlässlich, aber die weitere Verbesserung der elektrischen Leitfähigkeit, der Stickstoffdotierungseffizienz und der mesoporösen Eigenschaften ist der Schlüssel zur Verbesserung des ORR-Katalysators Aktivität.
Um die Wirkung der Pyrolysetemperaturen auf die ORR-Aktivität besser zu verstehen, stellten wir außerdem drei weitere Katalysatoren wie Me-CFZ-700, Me-CFZ-800 und Me-CFZ-1000 nach demselben Pyrolyseverfahren her. In Fig. 6a haben alle hergestellten Katalysatoren einen offensichtlichen ORR-Peak gezeigt, aber Me-CFZ-900 hat den größten Spitzenstrom und das positivste Spitzenpotential. LSV-Kurven, die bei einer Rotationsgeschwindigkeit von 1600 U/min aufgezeichnet wurden, deuten weiter darauf hin, dass der Me-CFZ-900 im Vergleich zu anderen Katalysatoren positivere Onset- und Halbwellenpotentiale für ORR gezeigt hat (Abb. 6b). Offensichtlich hängt die katalytische Aktivität der ORR unserer hergestellten Katalysatoren stark von der Pyrolysetemperatur ab. Die optimale Temperatur für unser System beträgt 900°C, da eine höhere oder niedrigere Temperatur immer noch eine schlechtere elektrokatalytische ORR-Aktivität ergibt. Dies kann an der Dichte der aktiven Zentren und den porösen Eigenschaften im Inneren von Katalysatoren liegen, die durch die Pyrolysetemperatur gesteuert werden. Um das kinetische Verhalten der ORR verschiedener kohlenstoffbasierter Katalysatoren besser zu verstehen, führen wir auch die RRDE-Tests durch, um den H2 . zu überwachen O2 Ausbeute und Elektronentransferzahl (Abb. 6c, d). Es ist zu erkennen, dass der Ringstrom (i r ) von Me-CFZ-900 ist im Potentialbereich von 0,2–0,8 V offensichtlich niedriger als bei anderen Katalysatoren, was zu der höchsten Elektronentransferzahl und der niedrigsten H2 . führt O2 Ausbeute auf Me-CFZ-900 basierend auf den RRDE-Daten. Diese Ergebnisse bestätigen weiter, dass die beste ORR-Aktivität der hergestellten Katalysatoren bei 900°C erhalten werden kann.
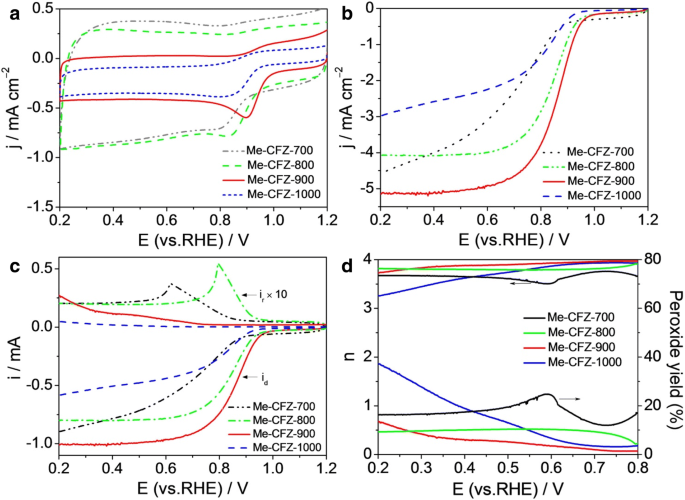
a Lebenslauf und b LSV-Kurven von Me-CFZ-700, Me-CFZ-800, Me-CFZ-900 und Me-CFZ-1000 in O2 -gesättigt 0.1 mol l −1 KOH-Lösung. c Scheiben- und Ringströme mit LSVs auf RRDE für Me-CFZ-700, Me-CFZ-800, Me-CFZ-900 und Me-CFZ-1000 in O2 -gesättigt 0.1 mol l −1 KOH-Lösung. d Die entsprechende Elektronentransferzahl und H2 O2 Ertrag von c
Das ORR-Katalyseverhalten von Me-CFZ-900 wurde weiter durch die CV-Kurven und LSV-Kurven in N2 . bewertet im Vergleich zu O2 -gesättigt 0.1 mol l −1 KOH-Lösungen (Abb. 7). In N2 -gesättigter Elektrolyt, abgesehen von einem klaren kapazitiven CV, ist in Abb. 7a kein sichtbarer Peak zu beobachten, was darauf hinweist, dass er merkmalslos ist. Im Gegensatz dazu, wenn der CV-Test in O2 . durchgeführt wird -gesättigter Elektrolyt wird ein wohldefinierter ORR-Peak bei ~ 0,90 V erhalten. Die obigen Ergebnisse deuten qualitativ auf eine elektrokatalytische ORR-Aktivität von Me-CFZ-900 mit einem ORR-Einsatzpotential von ~ 1.0 V hin, das sich dem kommerziellen Pt/C-Katalysator annähert (zusätzliche Datei 1:Abbildung S4). Um den ORR-Prozess von Me-CFZ-900 besser aufzudecken, wurden außerdem RDE-Messungen mit einer Abtastrate von 5 mV s −1 . durchgeführt mit unterschiedlichen Drehzahlen (400–2500 U/min), wie in Abb. 7b gezeigt. Die begrenzende Diffusionsstromdichte nimmt mit zunehmender Drehzahl zu, was zeigt, dass der Strom kinetisch kontrolliert wird. Die Koutecky-Levich-Plots (j −1 vs. ω −1/2 ), die bei 0,2–0,6 V erhalten wurden, zeigen eine gute Linearität und nahezu Parallelität (oder Überlappung) (Abb. 7a), was auf ähnliche Elektronentransferzahlen für die ORR bei fünf Potentialen (0,2–0,6 V) hinweist. Die durchschnittliche Elektronentransferzahl wird zu ~ 3.84 aus der Steigung der Koutecky-Levich-Diagramme unter Verwendung von Gl. (3) und (4), was weiter bestätigt, dass die ORR auf Me-CFZ-900 einem Vier-Elektronen-Reaktionsweg folgt, der dem des Pt/C-Katalysators ähnlich ist [33]. Dieses Ergebnis stimmt gut mit den RRDE-Testergebnissen überein. Darüber hinaus ist die Stabilität für die ORR-Elektrokatalyse eines der Hauptanliegen in der aktuellen alkalischen Brennstoffzellentechnologie. Dazu wurde die Langzeitstabilität von Me-CFZ-900 durch einen beschleunigten Alterungstest (AAT) in O2 . gemessen -gesättigte 0,1 µM KOH-Lösung. Vor erneuten LSV-Tests für ORR-Katalyse leidet der Me-CFZ-900-Katalysator unter kontinuierlichen CV-Messungen zwischen 0,2 und 1,2 V vs. RHE für 5000 Zyklen bei einer Abtastrate von 200 mV s −1 . Wie in Abb. 7d gezeigt, zeigen die LSV-Kurven von Me-CFZ-900 eine negative Verschiebung des Halbwellenpotentials von nur ~ 21 mV und eine Abnahme der begrenzten Diffusionsstromdichte von etwa 2,0 %, aber es wird keine merkliche Verringerung des ORR-Einsatzpotentials beobachtet . Unsere früheren Berichte zeigen, dass der kommerzielle Pt/C-Katalysator nach einem CV-Test für 5000 Zyklen im Allgemeinen eine negative Verschiebung des ORR-Halbwellenpotentials um ~ 50 mV zeigt. Diese elektrochemischen Ergebnisse deuten auf eine vielversprechende Langzeitstabilität von Me-CFZ-900 hin, die dem kommerziellen Pt/C-Katalysator offensichtlich überlegen ist (Zusatzdatei 1:Abbildung S5). Zusammenfassend können wir feststellen, dass der in dieser Arbeit hergestellte Me-CFZ-900-Katalysator ein vielversprechender Kandidat für Pt-basierte ORR-Katalysatoren im alkalischen Medium ist.
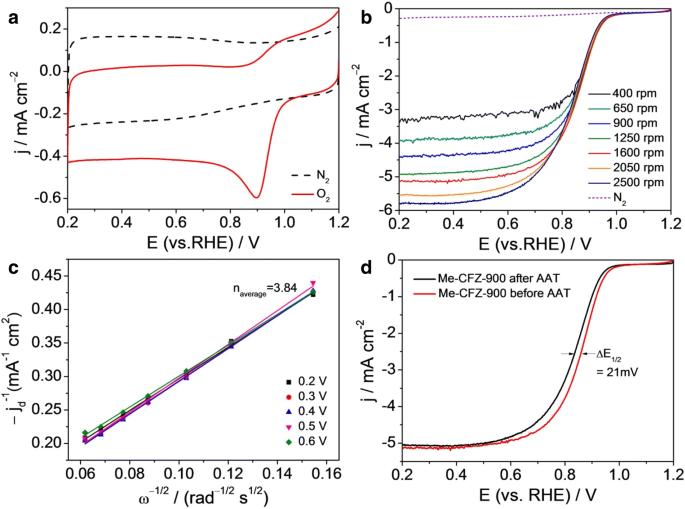
a CV-Kurven von Me-CFZ-900 in 0.1 mol l −1 KOH-Lösung gesättigt mit N2 im Vergleich zu O2 . b LSV-Kurven von Me-CFZ-900 in O2 -gesättigt 0.1 mol l −1 KOH-Lösung bei verschiedenen Rotationsgeschwindigkeiten (400–3600 rpm). c Koutecky-Levich-Plots von j d −1 vs. ω −1/2 erhalten von b bei gegebenen Potentialen. d LSV-Kurven von Me-CFZ-900 in O2 -gesättigt 0.1 mol l −1 KOH-Elektrolyte vor und nach dem AAT-Test
Schlussfolgerungen
In summary, we develop a new method to prepare nanoporous N-doped carbon microfibers (Me-CFZ-900) derived from bamboo-carbon biowastes for the electrocatalysis of oxygen reduction reaction in alkaline media. The as-prepared Me-CFZ-900 catalyst exhibits the ORR electrocatalytic activity with a half-wave potential of ~ 0.86 V and a peak potential of ~ 0.91 V. The peroxide yield less than 14% and the average electron transfer number of 3.84 are obtained on Me-CFZ-900, further showing a quasi-four-electron reaction pathway. An only 21 mV negative shift in half-wave potential and 2.0% decline in the limited current density are observed on Me-CFZ-900 after doing the accelerated aging test. Furthermore, high BET surface area (929.4 m 2 g −1 ) and mesoporous structure of Me-CFZ-900 can facilitate the adsorption and transportation of oxygen molecule. This work can help the researchers to build the high-performance carbon-based ORR electrocatalyst derived from biomass wastes and to understand the origin of the ORR electrocatalytic activity.
Abkürzungen
- AAT:
-
Accelerated aging test
- AE:
-
Auxiliary electrode
- BET:
-
Brunauer-Emmett-Teller
- CF:
-
Carbon microfibers
- CV:
-
Cyclic voltammetry
- E 1/2 :
-
Half-wave potential
- E ORR :
-
Onset potential
- E p :
-
Peak potential
- FE-SEM:
-
Field-emission scanning electron microscopy
- GC:
-
Glassy carbon
- HR-TEM:
-
Hochauflösende Transmissionselektronenmikroskopie
- LSV:
-
Linear sweep voltammetry
- Me-CFZ-900:
-
Nitrogen-doped porous carbon microfibers
- ORR:
-
Oxygen reduction reaction
- Pt/C:
-
Platinum/carbon catalyst
- RDE:
-
Rotation disk electrode
- RE:
-
Reference electrode
- RHE:
-
Reversible hydrogen electrode
- RRDE:
-
Rotation ring-disk electrode
- SCE:
-
Saturated calomel electrode
- WE:
-
Working electrode
- XPS:
-
Röntgenphotoelektronenspektroskopie
Nanomaterialien
- Neue Fütterungs- und Dosierungsbroschüre von Gericke
- Neue Durchbrüche in FDM von Stratasys
- Ein neues Buch von Dominque Cardon
- Aktivkohlefasern mit hierarchischer Nanostruktur aus Baumwollhandschuhabfällen als Hochleistungselektroden für Superkondensatoren
- Magnetische Kohlenstoff-Mikrosphären als wiederverwendbares Adsorptionsmittel zur Entfernung von Sulfonamid aus Wasser
- Ein einfacher Ansatz zur Synthese von fluoreszierenden Kohlenstoffquantenpunkten aus Tofu-Abwasser
- Selbstdotierter hochporöser Kohlenstoff mit hohem Graphitgehalt für die Elektrokatalyse von Sauerstoffreduktionsreaktionen
- Synthese und Superkondensatorleistung von Polyanilin/Stickstoff-dotierten geordneten mesoporösen Kohlenstoffverbundwerkstoffen
- Hochaktive und stabile Fe-N-C-Sauerstoffreduktions-Elektrokatalysatoren aus Elektrospinnen und In-situ-Pyrolyse
- Einfache Synthese von Stickstoff-dotierten mikroporösen Kohlenstoffkugeln für symmetrische Hochleistungssuperkondensatoren



