Antibakterielle Aktivität einer in situ hergestellten Lösung aus Chitosan/Silber-Nanopartikeln gegen Methicillin-resistente Stämme von Staphylococcus aureus
Zusammenfassung
Hintergrund
Untersuchung neuer wirksamer Medikamente gegen die Methicillin-resistenten Stämme von Staphylococcus aureus (MRSA) ist ein dringendes Thema der modernen Medizin. Antiseptika als Alternative zu Antibiotika sind starke, nachhaltige und wirksame Präparate gegen resistente Stämme und verletzen die Mikrobiozönose nicht.
Materialien und Methoden
Die Aktivität von in situ hergestellten Chitosan-Ag-Nanopartikeln (Ag-NPs) mit unterschiedlichen Komponentenverhältnissen wurde gegen MRSA getestet, die von Patienten isoliert wurden. Ag-NPs wurden mittels chemischer Reduktionsmethode unter Verwendung des Ansatzes der grünen Chemie synthetisiert. Um die antimikrobielle Aktivität und Dispergierbarkeit von Ag-NPs zu verbessern, wurde eine Oberflächenmodifikation von Ag-NPs mit Cetrimoniumbromid (CTAB) durchgeführt.
Ag-NPs und Chitosan-Ag-NPs-Lösung wurden mit Röntgenbeugung, Transmissionselektronenmikroskopie, Infrarotspektroskopie und spektrophotometrischen Messungen charakterisiert.
Ergebnisse und Schlussfolgerungen
Die Ergebnisse von XRD-, FTIR-, UV-Vis- und TEM-Messungen bestätigten die chemische Zusammensetzung von Chitosan- und Ag-NPs und ihre hohe Reinheit.
Chitosan-AgNPs-Lösungen haben ihre überlegene antimikrobielle Wirksamkeit im Vergleich zu ihren reinen Formen gezeigt. Gleichzeitig war eine in-situ-Herstellung von Chitosan-Ag-NPs-Lösung (Chitosan-Pulver 6,0 µg/ml, Ag/CTAB-NPs) aufgrund der Ausfällung der Komponenten nicht möglich. Dieses Ergebnis ist sehr vielversprechend und kann als wirksame Lösung im Kampf gegen arzneimittelresistente Bakterien angesehen werden.
Hintergrund
Infektionen bleiben weltweit eine der Hauptursachen für Morbidität und Mortalität, trotz des Vorhandenseins einer erheblichen Anzahl von Antibiotika und Antiseptika. Bei mittelschweren und schweren Infektionen wird eine Antibiotikatherapie in der Regel empirisch eingeleitet, bevor die Ergebnisse der bakteriologischen Untersuchung vorliegen. Durch den ständigen Einsatz von Antibiotika wurden günstige Bedingungen für die Selektion und Vermehrung antibiotikaresistenter Mikroorganismen geschaffen [22]. Eine hohe Prävalenz von Multiresistenzen gegen Erreger aller infektiösen Prozesse ist heute dokumentiert [6]. Das berüchtigtste multiresistente Bakterium ist das Methicillin-resistente Staphylococcus aureus (MRSA) [9]. Der Erreger ist für ein breites Spektrum an Erkrankungen bei Mensch und Tier verantwortlich, das von Hautinfektionen bis hin zu so schwerwiegenden Erkrankungen wie Lungenentzündung, Endokarditis und Septikämie reicht, und diese Infektionen können die menschliche Gesundheit beeinträchtigen [32]. Die Analyse der ätiologischen Ursachen von Infektionen bei Patienten mit unzureichender Therapie ergab, dass die Therapie in 32,6% der Fälle von MRSA-basierten Infektionen nicht ausreichend war [12] und mit jährlichen Gesundheitskosten in Höhe von 3–4 Milliarden US-Dollar verbunden waren [32].
Die Erforschung neuer wirksamer Medikamente gegen den MRSA ist ein dringendes Anliegen der modernen Medizin. Antiseptika als Alternative zu Antibiotika sind starke, anhaltende und aktive Präparate gegen resistente Stämme und verletzen die Mikrobiozönose nicht. Die Überwindung dieser Probleme erfordert neue und innovative Vorbereitungen. Der Ansatz, verschiedene antibakterielle Wirkmechanismen durch das Design hybrider Nanomaterialien zu kombinieren, bietet ein neues Paradigma im Kampf gegen resistente Bakterien [18]. Metalle wie Kupfer und Silber sind in außergewöhnlich niedrigen Konzentrationen extrem giftig für Bakterien. Aufgrund ihrer bioziden Aktivität wurden Metalle in einer Vielzahl von Anwendungen in der Landwirtschaft, im Gesundheitswesen und in der Industrie im Allgemeinen als antimikrobielle Wirkstoffe verwendet. Im Gegensatz zu anderen antimikrobiellen Wirkstoffen sind Metalle unter den gegenwärtig in der Industrie herrschenden Bedingungen stabil, die ihre Verwendung als Additive erlauben [19].
Die antimikrobiellen Eigenschaften von Silber sind seit der Antike bekannt, und die zunehmende Antibiotikaresistenz von Bakterien und die Unwirksamkeit synthetischer Antibiotika gegen einige Bakterienstämme haben dazu geführt, dass das Interesse an Silber, Silbersalzen, Silberverbindungen und nanokristallinem Silber als antibakterielle Wirkstoffe wieder aufgekommen ist. Silbernanopartikel (Ag-NPs) haben eine signifikante antibakterielle und antimykotische Wirkung [26]. Ag-NPs zeigen Synergismus mit anderen Antibiotika und Antiseptika (Ceftazidim, Streptomycin, Kanamycin, Polymyxin) [25, 38]. Aber J. Jains zeigte, dass Chloramphenicol die antibakterielle Wirkung von Ag-NPs-Lösung verringert [16].
Die Hauptnachteile, die den Einsatz von Ag-NPs einschränken, sind ihre leichte Aggregation, die unkontrollierte Freisetzung von Silberionen und ihr Zytotoxizitätspotential [40]. Die Kombination von Ag-NPs mit natürlichen Wirkstoffen wie Chitosan, Propolis, Tonen oder Zeolithen [33, 35] bietet zusätzliche Effekte. Die Kombination von Polymeren und Nanosilber kann ihre antimikrobielle Wirkung synergistisch verbessern, und die Verwendung von In-situ-Synthesemethoden ermöglicht seine Einbindung in die Polymermatrix, wodurch eine gleichmäßige Verteilung erreicht und eine Aggregation vermieden wird [28].
In den letzten Jahren hat sich die Effizienz von Methoden der Grünen Chemie zur Synthese metallischer Nanopartikel deutlich erhöht [1]. Pflanzenextrakte werden häufig als Reduktions-, Stabilisierungs- und Verkappungsmittel verwendet [23] und bieten kostengünstige und umweltfreundliche Methoden für die NP-Synthese. Unter den Pflanzenextrakten ist Ingwerextrakt aufgrund seiner chemischen und biologischen Eigenschaften von großem wissenschaftlichen Interesse [8]. Ingwerblattextrakt wurde bereits zur Synthese von Silber-NPs verwendet [37]; die erzeugten Partikel hatten jedoch eine ziemlich breite Partikelgrößenverteilung (10–100 nm). Ingwer-Rhizom wird häufig als Gewürz und Volksmedizin verwendet; sein Extrakt enthält spezifische phenolische Verbindungen:Gingerol und seine Derivate, eine Reihe von bioaktiven phenolischen und nicht-phenolischen Bestandteilen [31]. Diese Verbindungen weisen ein breites Wirkungsspektrum auf, einschließlich antimikrobieller, antimykotischer und antiviraler. Rhizom-Ingwer-Extrakt scheint ein vielversprechendes Substrat für die Entwicklung bioaktiver und biokompatibler Nanopartikel zu sein, da es auch antioxidative und entzündungshemmende Eigenschaften aufweist.
Chitin und Chitosan sind aufgrund ihrer bakteriostatischen/bakteriziden Eigenschaften und ihrer Biokompatibilität mit menschlichem Gewebe vielversprechende Materialien für medizinische Anwendungen [20]. Chitosan ist ein Derivat von Chitin, das durch Chitin-Deacetylierung gewonnen werden kann. Beide enthalten die gleichen Monomere, N -Acetyl-2-amino-2-desoxy-D-glucopyranose und 2-Amino-2-desoxy-D-glucopyranose, die sich im Anteil an acetylierten und deacetylierten Monomeren unterscheiden. Chitosan ist ein vielversprechendes Material für die Bildung von Kompositen mit verschiedenen Substanzen, einschließlich Metallnanopartikeln wie Ag und Cu [33]. Andererseits kann Cetrimoniumbromid (CTAB) Nanopartikel in Lösung stabilisieren und die Toxizität einiger Nanopartikel wie ZnO, TiO2 und Ni verringern [17]. Aber die Daten über die antibakterielle Aktivität des CTAB-NPs-Komplexes sind begrenzt [7].
Der Zweck dieser Forschung besteht darin, das optimale Verhältnis von Chitosan und Ag-NPs zu finden, die durch CTAB für eine Lösungszusammensetzung (Chitosan/Ag) modifiziert wurden, die gegen klinische MRSA-Stämme wirksam wäre.
Methoden
Materialien
Silbernitrat, L-Ascorbinsäure und Cetrimoniumbromid (C16 H33 )N(CH3 )3 Br (CTAB) wurden von Sigma-Aldrich bezogen und wie erhalten verwendet. Ingwer (Zingiber officinale , Zingiber-Akae ) Rhizom wurde in einem örtlichen Supermarkt (Poznan, Polen) gekauft. Chitosan 200 kDa, Deacetylierungsgrad 82% wurde von CJSC "Bioprogress" (Russland, Moskau) bezogen und ohne weitere Reinigung verwendet. Reinstwasser (Widerstand> 17 MΩcm − 1 ) aus einem GZY-P10-Wassersystem wurde während der gesamten Experimente verwendet. Alle Medien und Disketten mit Antibiotika wurden von Hi Media (Indien) gekauft.
In-situ-Herstellung von Chitosan/Ag-NP-Lösungen
Um die Chitosan/Ag-Lösungen in situ herzustellen, wurden zunächst Ag-NPs synthetisiert und modifiziert.
Synthese von Ag-NPs
Ag-NPs wurden mittels chemischer Reduktionsmethode unter Verwendung des Ansatzes der grünen Chemie synthetisiert. Nach diesem Ansatz haben wir Ingwer (Zingiber officinale ) Extrakt als Tensid und Ascorbinsäure (Vitamin C) als Reduktionsmittel. Zur Herstellung von Ingwer-Rhizom-Extrakt wurden 250 g Rhizom gründlich mit destilliertem Wasser gewaschen und dann in kleine Stücke geschnitten. Gehacktes Ingwer-Rhizom wurde in einer Wasser-Ethanol-Lösung (250 ml, Verhältnis 1:1) für 5 Tage (bei Raumtemperatur, an einem dunklen Ort) aufbewahrt. Dann wurde der Überstand vakuumfiltriert (durch ein Whatman-Filterpapier) und gelagert (bei 4 °C). Um Ag-NPs zu synthetisieren, wurde Silbernitrat (840 mg) in Wasser (20 ml) gelöst und Ingwer-Rhizom-Extrakt (20 ml) wurde zugegeben. Dann wurde eine Mischung aus einer Lösung von L-Ascorbinsäure (10 %, 10 ml) und Ingwerextrakt (20 ml) unter magnetischer Steuerung zu der Silbernitratlösung getropft. Die Reaktionsmischung wurde dunkel. Dann wurde es unter Rückfluss erhitzt (60 °C, 1,5 h). Dann wurden frisch synthetisierte Ag-NPs mit Wasser gewaschen, bis der pH-Wert 7 erreichte, wobei Zentrifugation (4000 U/min, 30 Minuten) verwendet wurde.
Um die antimikrobielle Aktivität und Dispergierbarkeit von Ag-NPs zu verbessern, wurde die Oberflächenmodifizierung von Ag-NPs durch CTAB durchgeführt, die aufgrund ihrer oberflächenaktiven und antiseptischen Eigenschaften bekannt ist [17]. Typischerweise wurde die Dispersion von Ag-NPs (3 ml, 76,4 mg/ml) mit CTAB-Lösung (20 ml, 6,7 mg/ml) gemischt und beschallt (3 h). Dann wurde der Überstand für UV-Vis-Messungen gesammelt und die Ag-NPs wurden dreimal unter Verwendung von Zentrifugation (4000 U/min, 30 min) mit Wasser gewaschen. Der CTAB-Gehalt im Überstand wurde unter Verwendung der spektrophotometrischen Technik (UV-Vis) durch Überwachung der Intensität des 190-nm-Peaks bestimmt. Die Adsorptionsfähigkeit von Ag-NPs (in mg/g) gegenüber CTAB wurde aus der Differenz zwischen dem anfänglichen CTAB-Gehalt in der Lösung und seinem Gehalt im Überstand nach Wechselwirkung mit der Probe berechnet. Die Adsorptivität und der CTAB-Ladeinhalt wurden anhand der folgenden Gleichungen berechnet:
Adsorptivität (mg/g) = (Gewicht von CTAB in Lösung − Gewicht von CTAB im Überstand)/(Gewicht von Ag-NPs),
CTAB-Beladungsgehalt (%) = (1 − (Gewicht der Ag-NPs)/(Gewicht der CTAB-beladenen Ag-NPs)) × 100%.
In-situ-Herstellung von Chitosan/Ag-NP-Lösungen
Um Chitosan/Ag-NPs-Lösungen zu erhalten, wurde 200 kDa Chitosan (1 g) in 2 % Essigsäure (100 ml) bei Raumtemperatur während 24 Stunden gelöst, um eine 1 %ige Chitosanlösung zu bilden. In Experimenten wurden zwei Proben von Ag-NPs verwendet – reine Ag-NPs und Ag-NPs-CTAB.
Physikochemische Charakterisierung von Ag-NPs und Chitosan
Pulverröntgenbeugungsuntersuchungen (XRD) wurden an einem Empyrea-Diffraktometer (PANalytical) unter Verwendung von Cu Kα-Strahlung (1,54 Å), einem Reflexions-Transmissions-Spinner (Probentisch) und einem PIXcel-3D-Detektor durchgeführt, der in der Bragg-Brentano-Geometrie arbeitet . Die 2Theta-Scans wurden bei Raumtemperatur in Winkeln von 10° bis 95° mit einer Schrittweite von 0,007° im kontinuierlichen Scan-Modus aufgenommen.
Transmissionselektronenmikroskopie (TEM)-Messungen wurden mit einem JEM-ARM-200F-Transmissionselektronenmikroskop durchgeführt, das bei einer Beschleunigungsspannung von 200 kV betrieben wurde.
Die Infrarotspektren wurden unter Verwendung eines Spektrometers Tensor 27 (Bruker Optics), das mit einer globalen Quelle und einem MCT-Detektor ausgestattet war, erhalten. Proben wurden unter Verwendung von Kaliumbromid als Matrixmaterial hergestellt und in Anteilen von 1 mg Probe zu 200 mg KBr gemischt. Pellets wurden unter Verwendung der Standardtechnik unter einem Druck von 10 Tonnen/cm 2 . hergestellt mit einem Lauf von 16 mm Durchmesser. Die Messungen wurden bei Raumtemperatur durchgeführt. Für jedes Spektrum 512 Scans im Spektralbereich von 4000–400 cm − 1 wurden mit einer Auflösung von 4 cm − 1 aufgenommen. Die Daten wurden mit dem Opus-Softwarepaket verarbeitet.
Spektrophotometrische Messungen (UV–Vis) wurden mit dem UV/VIS/NIR-Spektrometer Lambda 950 (Perkin Elmer) bei Wellenlängen von 200–800 nm mit Wasser als Bezugslösung durchgeführt.
Mikrobiologische Tests
Bakterienkultur
Bakterienkulturen wurden aus dem Bereich des mittleren Nasengangs und aus dem Rachen der 70 stationären Patienten mit sterilen Wattestäbchen entnommen. Die Proben wurden sofort in Transportmedien ins Labor transportiert und anschließend auf Blutagar beimpft. Bakterienkulturen wurden morphologisch und biochemisch durch Standardlaborverfahren gemäß dem Manual of Methods for General Bacteriology im bakteriologischen Labor der Sumy State University identifiziert. Wir haben 50 Staphylococcus aureus isoliert Stämme. Jede Kultur wurde einer Gram-Färbung unterzogen und auf Produktion von Katalase, freier Koagulase, gelbem Pigment, Mannit-Fermentation, Wachstum bei hoher Salzkonzentration und Lipase-Produktion auf Eigelb-Agar-Medium (Hi Media, Mumbai) getestet.
Antimikrobielle Empfindlichkeitsprüfung
An allen S . wurden Antibiotika-Empfindlichkeitstests durchgeführt . aureus Isolate, um ihr Antibiotikaresistenzprofil zu bestimmen. Zur Beurteilung der Antibiotikaempfindlichkeit der Isolate wurde die Kirby-Bauer-Scheibendiffusionsmethode verwendet. Antimikrobielle Empfindlichkeitstests wurden auf Muller-Hinton-Agar gegen Azithromycin, Levofloxacin, Clarithromycin, Ciprofloxacin und Methicillin durchgeführt (National Committee for Clinical Laboratory Standards, 1999). Frische Übernachtkulturen wurden hergestellt und in Tests verwendet. Standardstamm von S . aureus ATCC 25923 wurde als Kontrolle verwendet. Ein Aliquot (100 μl) von jeder Isolatsuspension wurde auf Mueller-Hinton-Agar ausgestrichen. Antibiotika-Scheiben wurden vorsichtig auf den beimpften Mueller-Hinton-Agar gepresst, um einen innigen Kontakt mit der Oberfläche zu gewährleisten, und die Platten wurden bei 37 °C für 18–24 h aerob inkubiert. Die Durchmesser der Hemmzone wurden gemessen. Klinische Stämme wurden gemäß den Bewertungskriterien, die von den Richtlinien des Clinical and Laboratory Standards Institute (CLSI) entwickelt wurden, als anfällig und resistent kategorisiert [24]. Die Stämme von Staphylococcus aureus die sich als resistent gegen Methicillin erwiesen, wurden als MRSA gescreent.
Bestimmung der minimalen Hemmkonzentrationen von Chitosan-Ag-NP-Lösungen
Antimikrobielle Aktivitäten von Chitosan-Lösung, Ag-NPs und Chitosan-Ag-NPs-Lösungen wurden gemäß den Empfehlungen von NCCLS (1999) unter Verwendung einer Bouillon-Makrodilutionsmethode bestimmt. Wir haben die minimale Hemmkonzentration (MHK) für Testlösungen gegen jeden Methicillin-resistenten Staphylococcus aureus bestimmt (insgesamt 10 MRSA-Stämme). Das Röhrchen mit der niedrigsten Konzentration, das das visuelle Wachstum von Bakterien vollständig hemmt (keine Trübung), wurde als MHK betrachtet.
Kurz gesagt, zu Beginn wurden sieben Konzentrationen von reinen Ag-NPs und Ag/CTAB-NPs unter Verwendung von Nährbrühe mit der 2-fach seriellen Verdünnungsmethode hergestellt. Es gab drei identische Reihen jeder Art von Ag-NPs-Verdünnung. Dann haben wir in jedes Röhrchen jeder Reihe 1, 2 oder 3 ml einer 1%igen Chitosanlösung gegeben. Die Endkonzentration von Chitosan und Ag-NPs in den getesteten Röhrchen ist in Tabelle 1 aufgeführt.
Testbakterienstämme wurden in einer geeigneten Brühe gezüchtet, einmal in steriler Kochsalzlösung gewaschen und in destilliertem Wasser verdünnt. Die Bakterienkonzentration wurde auf eine optische Dichte von 0,08 bei 600 nm (ungefähr 1,5 × 10 8 UFC/ml) nach der McFarland-Skala. Dann 100 μl S . aureus Suspension wurde in Röhrchen mit Ag-NPs, Chitosan-Lösung und Ag-NPs-Chitosan-Lösung inokuliert. Als Kontrollen wurden Röhrchen mit Wachstumsmedium und getesteten Proben ohne Inokulum verwendet. Alle Röhrchen wurden 24 h bei 37 °C aerob inkubiert. Alle Maßnahmen waren dreifach.
Ergebnisse
Charakterisierung von Ag-NPs und Chitosan zur In-situ-Lösungsherstellung
Ein Teil der synthetisierten Ag-NPs wurde durch CTAB (Ag/CTAB-NPs) modifiziert (um die Bioaktivität und Stabilität von Ag-NPs-Dispersionen zu verbessern). Die Adsorptionsfähigkeit von Ag-NPs gegenüber CTAB wurde mit 70,0 mg/g ermittelt, was einem CTAB-Gehalt von etwa 6,54% in der Probe entspricht.
Die Ergebnisse von XRD-Messungen von Ag-NPs zeigten das Vorhandensein von vier scharfen Peaks bei 38,15, 44,33, 64,48, 77,47 und 81,54 °2Theta (Abb. 1a). Laut der American Mineralogist Crystal Structure Database (AMCSD) [5] wurden diese Spitzen dem Silber zugeschrieben. Der breite Peak zwischen 12.00–21.06 °2Theta kann auf organische Verbindungen zurückgeführt werden, die aus der Synthese stammen (L-Ascorbinsäure und Ingwer). Das XRD-Muster von Chitosan (Abb. 1a, Einschub) weist Beugungspeaks bei etwa 9 und 20 °2Theta auf, die typische Fingerabdrücke von teilkristallinem Chitosan sind [5]. Die Kristallinität von Chitosan wird durch Wasserstoffbrückenbindungen zwischen dem entsprechenden Hydroxyl und N . erzeugt -Acetylgruppen. Jeder kristalline Peak charakterisiert die kristallographische Struktur, die aus parallelen und antiparallelen Ausrichtungen von Polymerketten oder -schichten erzeugt wird. Semikristallines Chitosan hat amorphe und kristalline Bereiche.
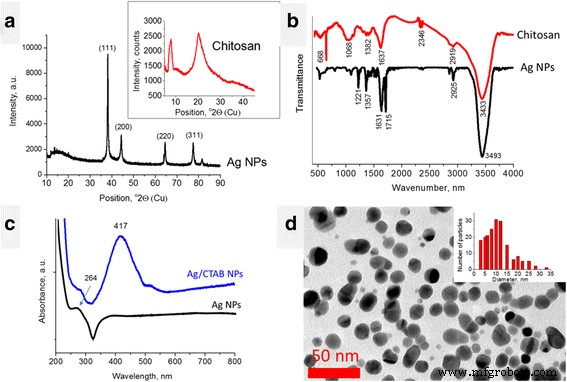
Charakterisierung von Ag-NPs und Chitosan. a XRD-Muster, b FTIR-Spektren, c UV-Vis-Absorptionsspektrum von Ag-NPs (Wasser), d TEM-Aufnahme von Ag-NPs
FTIR-Spektren von Chitosan und Ag-NPs sind in Abb. 1b gezeigt. Das Chitosanspektrum zeigt breite und intensive Banden bei 3450–3200 cm − 1 (wasserstoffgebundene OH-Streckschwingungen) überlappt mit NH-Streckbändern, CH-Streckband bei 2783 cm − 1 , und die Bande für Amid I bei 1652 cm − 1 (Abb. 1b). Biegeschwingungen von Methylen- und Methylgruppen sind auch bei ν . sichtbar = 1375 cm − 1 und ν = 1426 cm − 1 , bzw. Absorption im Bereich von 1160 bis 1000 cm − 1 wurde Schwingungen der CO-Gruppe zugeschrieben. Die Band in der Nähe von ν = 1150 cm − 1 hängt mit asymmetrischen Schwingungen von CO in der Sauerstoffbrücke zusammen, die aus der Deacetylierung von Chitosan resultieren. Die Bänder in der Nähe von 1080–1025 cm − 1 werden ν . zugeschrieben CO des Rings COH, COC und CH2 OH. Der kleine Peak bei ~ 890 cm − 1 entspricht dem Wagging der Saccharidstruktur von Chitosan [11, 13].
Das FTIR-Spektrum von Ag-NPs zeigte mehrere intensive Peaks bei 1226, 1366, 1636, 1714, 2851, 2924 und 3438 cm − 1 . Letztere wurden den H-verbrückten OH-Gruppen zugeschrieben. Die Spitzen bei 1226 und 1366 cm − 1 sind auf CO- und CH-Biegeschwingungen zurückzuführen; Doppelpeak bei 1636 und 1714 cm − 1 weisen auf das Vorhandensein von C=C- und C=O-Gruppen (Streckschwingungen) hin. Die Spitzen bei 2851 und 2924 cm − 1 hängen mit CH-Streckschwingungen zusammen [13]. Das Vorhandensein organischer Gruppen auf der Oberfläche der Ag-NPs ist auf organische Verbindungen zurückzuführen, die für ihre Synthese verwendet wurden, L-Ascorbinsäure und Ingwer, die als FTIR-Spektren bekannt sind [10]. Wenn wir die Spektren der letzteren mit denen der Ag-NPs vergleichen, kann man feststellen, dass der Doppelpeak bei 1636 und 1714 cm − 1 ist dem Spektrum der L-Ascorbinsäure inhärent und blauverschoben. Die intensivsten Ingwerspitzen innerhalb von 1000–1200 cm − 1 (COC-Schwingungen) werden im Ag-NP-Spektrum nicht intensiv ausgedrückt. Daher spielt L-Ascorbinsäure die vorherrschende Rolle bei der Reduktion von Silberionen, der Übertragung von zwei Elektronen und der Umwandlung in Dehydroascorbinsäure [29]. Die Blauverschiebung der Peakposition von L-Ascorbinsäure weist auf die chemische Bindung dieses Moleküls auf der Oberfläche der Ag-NPs hin.
Das UV-Vis-Absorptionsspektrum der in Wasser dispergierten Ag-NPs (Abb. 1c) zeigte den asymmetrischen Peak bei etwa 387 nm. Der Peak innerhalb von 387–420 nm ist als charakteristischer Peak für Ag-NPs bekannt und wird normalerweise dem Oberflächenplasmonenresonanzeffekt zugeschrieben [30]. Die Asymmetrie dieses Peaks (Plateau) kann der schnellen Ausfällung von Ag-NPs zugeschrieben werden. Der Peak bei etwa 264 nm ist auch für Ag-NPs bekannt und hängt normalerweise mit dem Übergang von Elektronen in höhere Energiezustände in Ag-NPs zusammen [38]. Andererseits zeigte das UV-Vis-Spektrum von L-Ascorbinsäure auch einen Peak bei 255 nm [4]. Daher kann der Peak bei 264 nm im Ag-NP-Spektrum als rotverschobener Peak von L-Ascorbinsäure betrachtet werden, der das Vorhandensein dieser chemisch gebundenen Moleküle auf der Ag-NP-Oberfläche bestätigt.
Interessanterweise zeigte das UV-Vis-Spektrum von Ag/CTAB-NPs (Abb. 1c, blaue Linie) einen symmetrischen Peak bei 417 nm. Dies bestätigte, dass die Stabilität von Ag-NPs in Wasser aufgrund der Oberflächenmodifikation durch CTAB-Moleküle verbessert wurde.
TEM-Messungen ergaben, dass Ag-NPs eine rundliche Form haben und die meisten von ihnen 10–12 nm groß sind (Abb. 1d).
Antibakterielle Wirkung der in situ hergestellten Chitosan/Ag-NP-Lösungen gegen Methicillin-resistente Stämme von Staphylococcus aureus
Die MHK von reinen Ag-NPs und Ag/CTAB-NPs gegen 100 % MRSA betrug 9,6 μg/ml. Die niedrigsten Konzentrationen haben geringere Aktivitäten gezeigt (Tabelle 2). Chitosan-Lösung zeigt antibakterielle Aktivität mit einer MHK von 6 μg/ml gegen 100 % klinische MRSA-Stämme. Unter ihnen wiesen 60 % der Stämme eine MHK von 3,3 und eine Chitosanlösung von 5 μg/ml auf.
Die hemmende Wirkung der Chitosan-Ag-NPs-Lösung gegen MRSA ist in Abb. 2a dargestellt. Es wurde festgestellt, dass die Chitosan-Ag-NPs-Lösung im Vergleich zu ihren reinen Formen eine überlegene antimikrobielle Wirksamkeit aufwies. Gleichzeitig war eine in-situ-Herstellung von Chitosan-Ag-NPs/CTAB-Lösung (Chitosan 6,0 μg/ml, Ag/CTAB-NPs) aufgrund der Ausfällung der Komponenten nicht möglich:Bildung grau-schwarzer Ringagglutination und Abtrennung der Komponenten in zwei Phasen. Die antibakterielle Aktivität konnte in diesem Fall nicht bewertet werden. Unter Berücksichtigung des unerwarteten Ergebnisses der Mischung von Chitosan und CTAB und der niedrigsten antibakteriellen Aktivität von Ag-NPs-CTAB (siehe Abb. 2b) kamen wir zu dem Schluss, dass die Oberflächenmodifikation von Ag-NPs durch CTAB nicht vielversprechend ist. Das Vorhandensein von CTAB-Molekülen auf der Oberfläche von Ag-NPs verbesserte die Stabilität von Wasserdispersionen, verringerte jedoch die antimikrobielle Aktivität erheblich und verursachte eine Ausfällung der Lösung.
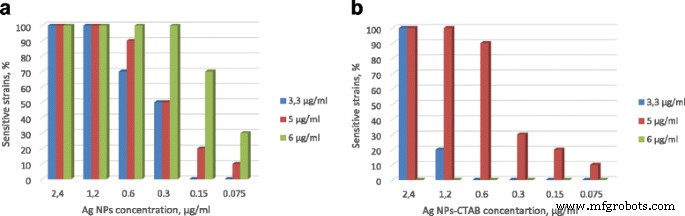
Der Prozentsatz empfindlicher MRSA-Stämme nach der Behandlung. Chitosan-Ag-NPs-Lösung (a ) und Chitosan-AgNPs-CTAB-Lösung (b ). 3,3, 5 und 6 μg/ml – das sind die Konzentrationen von Chitosan in Lösung
Diskussion
Toxizität bezieht sich auf alle schädlichen Auswirkungen auf einen Organismus während der Exposition gegenüber Nanopartikeln und deren Salzen. Wenn ein bestimmter Organismus sterilisiert oder desinfiziert werden soll, kann die Toxizität als positives Ergebnis interpretiert werden (antibakteriell, antiviral) [15]. Der aktuelle Grundbedarf in der Nanotechnologie ist die Entwicklung umweltfreundlicher und zuverlässiger Methoden zur Synthese von metallischen Nanopartikeln. Wir haben die Verwendung von biologischen Reduktionsmitteln, die natürliche, kostengünstige und umweltfreundliche Materialien sind, zur Herstellung von Silbernanopartikeln bestätigt, um das Vorhandensein riskanter und toxischer Lösungsmittel zu vermeiden [37]. Die Verwendung von Ag-NPs als Therapeutika ist aufgrund ihrer Zytotoxizität gegenüber Säugerzellen begrenzt. Mehrere Faktoren können die Wirkung von Ag-NPs gegen Mikroorganismen beeinflussen, wie Größe, Form, Stabilität und Konzentration von Ag-NPs [4].
In unserer Forschung erhielten wir Ag-NPs mit einer Größe von 5–18 nm. Es ist einer der grundlegendsten Parameter, die die optischen [39], antimikrobiellen [27] und antiviralen Eigenschaften von Ag-NPs [21] beeinflussen. Kleinere Partikel zeigen eine größere antibakterielle Aktivität. Einige Studien zeigten, dass sich NPs mit mehr als 10 nm auf der Zelloberfläche anreichern und die Zellpermeabilität beeinträchtigen; NPs, die kleiner als 10 nm sind, dringen jedoch in die Bakterien ein und beeinflussen die DNA und die Enzyme, was zum Zelltod führt [14]. Es ist interessant festzustellen, dass, obwohl die meisten Ergebnisse bewiesen, dass die Toxizitätshypothese mit abnehmender Partikelgröße zunimmt, es auch experimentelle Daten gibt, die zeigen, dass kleinere NPs entweder weniger toxisch waren oder keine größenabhängige Toxizität aufwiesen [15]. Es gibt viele Studien, die die antimikrobielle Aktivität der Ag-NPs im Größenbereich von 3 bis 100 nm zeigten [19].
Wie bereits erwähnt, wurden die Auswirkungen von Chitosan auf die Stabilität und die antimikrobiellen Eigenschaften der synthetisierten Ag-NPs untersucht. Vor der Empfindlichkeitsprüfung wurden die synthetisierten Nanopartikel verschiedenen Charakterisierungsmethoden unterzogen, um ihre Reinheit zu bestimmen. Unsere Untersuchungen haben gezeigt, dass Ag-NPs in einer Konzentration von 9,6 μg/ml gegen 100 % der MRSA-Stämme wirksam sind und CTAB die Wirksamkeit von Ag-NPs nicht erhöht.
Es ist bekannt, dass Chitosan eine signifikante antibakterielle Wirkung gegen ein breites Spektrum von Bakterien besitzt [2]. Trotzdem deuten einige Berichte darauf hin, dass reines Chitosan schwere Infektionen nicht verhindert [3]. Es gab mehrere Veröffentlichungen, in denen über verschiedene Kombinationen von Chitosan und Silber mit verbesserten antimikrobiellen Eigenschaften berichtet wurde [11]. Silber-Chitosan-Nanokomposite wurden als Beschichtungen für biomedizinische Technik, Lebensmittelverpackungen und Wundauflagen vorgeschlagen [2, 3]. Über die antibakterielle Wirkung von Chitosan-Ag-NPs-Lösung gegen MRSA liegen jedoch nur begrenzte Daten vor [34]. Unsere Daten zeigen, dass einfaches Mischen von Ag-NPs in Chitosanlösung die antibakterielle Aktivität beider Komponenten verbessern kann. Wir erhalten von allen untersuchten Substanzen eine Erhöhung der antibakteriellen Aktivität. Die MHK von Chitosan betrug 3,3 µg/ml und die MHK von reinen Ag-NPs und von Ag-NPs mit CTAB-MHK betrugen 1,2 bzw. 2,4 µg/ml. Kaur et al. (2013) berichteten auch über die antibakterielle Aktivität von Silber/Chitosan-Nanokompositen gegen S . aureus , in denen sie ähnliche Ergebnisse zeigten [36], aber sie bestimmten die MHK nicht. Dieses Ergebnis zeigt die Wirksamkeit der Chitosan-Ag-NPs-Lösung, aber wir sahen keine Vorteile von CTAB als antibakterielles Mittel. Im Gegenteil, eine andere Studie zeigte, dass mit CTAB stabilisierte Ag-NPs eine ausgeprägte antibakterielle Wirkung gegen S . haben . aureus und Escherichia coli . Wahrscheinlich verbindet sich Chitosan in unserem Experiment mit CTAB, das die Wirkung von Ag-NPs auf Bakterienzellen verringert.
Schlussfolgerungen
In dieser Studie wurde die Aktivität von in situ hergestellten Chitosan-Ag-NP-Lösungen mit unterschiedlichen Komponentenverhältnissen gegen aus Patienten isolierten MRSA getestet. Unsere Ergebnisse zeigten, dass einfaches Mischen der Chitosanlösung und der Ag-NPs die minimale Hemmkonzentration der Substanzen auf das 2- bzw. 4-Fache (3,3 bzw. 1,2 μg/ml) reduziert. Dieses Ergebnis ist sehr vielversprechend und kann als wirksame Lösung im Kampf gegen arzneimittelresistente Bakterien angesehen werden. Es ist auch ein Fortschritt in Richtung personalisierte Medizin. Zukünftige Zytotoxizitätsstudien von Chitosan-Ag-NPs-Lösung würden eine Antwort auf die für die klinische Anwendung geeigneten Dosen geben.
Abkürzungen
- Ag-NPs:
-
Silbernanopartikel
- ARI:
-
Akute Atemwegsinfektionen
- CTAB:
-
Cetrimoniumbromid
- FTIR:
-
Fourier-Transformations-Infrarotspektroskopie
- MRSA:
-
M Ethicillin-resistente Stämme von Staphylococcus aureus
- TEM:
-
Transmissionselektronenmikroskopie
- UV–Vis:
-
Ultraviolett-sichtbare Spektroskopie
- XRD:
-
Röntgenbeugung
Nanomaterialien
- Biokompatible FePO4-Nanopartikel:Wirkstofftransport, RNA-Stabilisierung und funktionelle Aktivität
- Biogene Synthese, Charakterisierung und Bewertung des antibakteriellen Potenzials von Kupferoxid-Nanopartikeln gegen Escherichia coli
- Herstellung und verbesserte katalytische Hydrierungsaktivität von Sb/Palygorskit (PAL)-Nanopartikeln
- Synergistische Effekte von Ag-Nanopartikeln/BiV1-xMoxO4 mit erhöhter photokatalytischer Aktivität
- Bestimmung der katalytischen Aktivität von Übergangsmetall-dotierten TiO2-Nanopartikeln mittels spektroskopischer Oberflächenanalyse
- Neueste Fortschritte bei Synthesemethoden und Anwendungen von Silbernanostrukturen
- Graphenoxid-basierte Nanokomposite, dekoriert mit Silbernanopartikeln als antibakterielles Mittel
- Eigenschaften von Zinkoxid-Nanopartikeln und ihre Wirkung gegen Mikroben
- In-situ-Synthese von bimetallischen Wolfram-Kupfer-Nanopartikeln durch thermisches Hochfrequenzplasma (RF)
- Poly(γ-Glutaminsäure) fördert die verstärkte Dechlorierung von p-Chlorphenol durch Fe-Pd-Nanopartikel



