Artesunat-beladene und Nahinfrarot-farbstoffkonjugierte Albumin-Nanopartikel als hocheffizienter, auf Tumoren ausgerichteter photochemo-theranostischer Wirkstoff
Zusammenfassung
Hier wurde ein auf Tumoren ausgerichtetes multifunktionales Theranostikum mit einer einfachen Methode synthetisiert, die vier klinisch zugelassene Materialien kombiniert:Artesunat (Arte), Humanserumalbumin (HSA), Folsäure (FA) und Indocyaningrün (ICG). Die erhaltenen Nanokomposite (FA-IHA NPs) zeigten eine ausgezeichnete photo- und physiologische Stabilität. Das ICG in den FA-IHA NPs wurde nicht nur für die Nahinfrarot(NIR)-Fluoreszenzbildgebung, sondern auch für die photothermische und photodynamische (PTT-PDT) Therapie unter einer einzigen NIR-Bestrahlung verwendet. Darüber hinaus ist die NIR-Strahlung (808 nm, 1 W/cm 2 ) könnte eine Arte-Freisetzung auslösen, die eine verstärkte chemotherapeutische Wirkung zeigte. Durch Fluoreszenzbildgebung wurde die Zellaufnahme und Tumorakkumulation von FA-IHA-NPs in vitro und in vivo beobachtet und durch konfokale Mikroskopie und NIR-Fluoreszenzbildgebung bei Tumor-Xenotransplantat-Mäusen analysiert. Basierend auf den diagnostischen Ergebnissen, FA-IHA-NPs 24 h nach der Injektion und kombiniert mit NIR-Bestrahlung (808 nm, 1 W/cm 2 ) konnte das Tumorwachstum durch eine Photo-Chemo-Kombinationstherapie ohne Tumorrezidive in vitro und in vivo wirksam unterdrücken. Die erhaltenen Ergebnisse legen nahe, dass FA-IHA-NPs vielversprechende photochemo-theranostische Wirkstoffe für die zukünftige klinische Translation sind.
Hintergrund
Die bildgebende Photochemotherapie (IGPC) hat in den letzten Jahrzehnten bei vielen Forschern großes Interesse auf sich gezogen, da sie eine vielversprechende Strategie zur Realisierung einer personalisierten Tumortherapie darstellt [1, 2]. IGPC ermöglicht die genaue Lokalisierung des Tumors und verfolgt das Medikament in vivo, was eine wirksame Therapie garantiert und Nebenwirkungen reduziert [3, 4]. Um wirksam zu sein, sollte IGPC die folgenden Eigenschaften aufweisen:(i) ein multifunktionales theranostisches Mittel mit sowohl bildgebenden als auch therapeutischen Funktionen wird benötigt; (ii) das Theranostikum sollte biokompatibel, stabil und spezifisch gegen den Tumor sein [5,6,7,8]. Die bildgebende Diagnosemodalität in der IGPC umfasst in der Regel Magnetresonanztomographie, photoakustische Bildgebung und Fluoreszenzbildgebung [9,10,11,12,13,14]. Aufgrund der hohen Empfindlichkeit, der günstigen zeitlichen Auflösung und des hohen Signal-Hintergrund-Verhältnisses wurde die Fluoreszenzbildgebung üblicherweise in der Grundlagenforschung und in der klinischen Praxis eingesetzt [15, 16].
Zu den Methoden der Photochemotherapie zählen hauptsächlich die Photothermische Therapie (PTT), die Photodynamische Therapie (PDT) und die Chemotherapie. Da die Bestrahlung im nahen Infrarot (NIR) gleich ist, können PTT- und PDT-Funktion in einem integriert werden, was eine selektive und effiziente Zerstörung des Tumors durch einen Laserstrahl ermöglicht. Es wurde jedoch berichtet, dass die photothermische und photodynamische (PTT-PDT) Therapie oft die Einschränkung einer unvollständigen Tumorsuppression hat, die möglicherweise einen Tumorrezidiv auslösen kann [17,18,19]. Chemotherapie, eine weit verbreitete Behandlungsmethode gegen Krebs, kann Tumorzellen durch systemische Verabreichung effektiv abtöten, obwohl die Toxizität für nahegelegene normale Zellen aufgrund ihrer Unspezifität ihre Anwendung einschränkt [20,21,22]. Daher könnte die IGPC-Kombination eine großartige Strategie sein, um die oben genannten Einschränkungen zu überwinden.
Mit der Entwicklung der Nanomedizin wurden theranostische IGPC-Wirkstoffe entwickelt, darunter Indocyaningrün (ICG), metallbasierte Nanopartikel, Kohlenstoff-Nanomaterialien und Polymer-Nanomaterialien [23,24,25,26,27]. Unter ihnen wurde ICG von der FDA zugelassen, und seine Verwendung in der klinischen Praxis wird berichtet, um das Herzzeitvolumen, die Leberfunktion, den Blutfluss und die ophthalmologische Angiographie zu erkennen [28, 29]. Darüber hinaus hat ICG eine hohe Absorptionseffizienz im NIR-Bereich, wodurch ein hoher PTT-PDT-Effekt unter einer einzigen NIR-Bestrahlung induziert wird [30]. Die folgenden Nachteile wie Instabilität in wässriger Lösung, schnelle Clearance im Körper, Neigung zum Selbstbleichen und fehlendes Targeting verhindern jedoch eine umfassende Anwendung stark [31, 32]. Um diese Einschränkungen zu überwinden, werden freie ICG-Moleküle normalerweise von Vehikeln wie Micellen, Polymer-Nanopartikeln und selbstorganisierten Protein-Nanostrukturen getragen, um Nanokomposite zu bilden [33, 34]. Obwohl verwandte Arbeiten verfügbar sind, werden noch mehr biokompatible und neuartige ICG-basierte Nanokomposite für die In-vivo-Bildgebung und Phototherapie benötigt.
In dieser Arbeit berichteten wir über einen zielgerichteten IGPC-Wirkstoff, der Folsäure (FA) und ICG kovalent mit Nanopartikeln aus Humanserumalbumin (HSA) konjugierte, die auch das Krebsmedikament Artesunat (Arte) (FA-IHA NPs) einkapselten. Es wurde berichtet, dass FA Nanopartikel verknüpft, um ihre Zellaufnahmeeffizienz über rezeptorvermittelte Endozytose zu erhöhen [17]. HSA ist ein körpereigenes Protein. Aufgrund seiner guten Biokompatibilität, nicht-toxischen und nicht-immunogenen Wirkung hat sich HSA zu einem der aufregendsten Träger für die Abgabe unlöslicher Krebsmedikamente entwickelt [12, 17, 31]. Arte, ein natürliches Medikament aus Artemisia annua , hat sich bei der Behandlung verschiedener Krebsarten wie Leberkrebs, Lungenkrebs und Brustkrebs als signifikant wirksam erwiesen [35]. Die präparierten FA-IHA-NPs bestanden aus diesen vier klinisch zugelassenen Materialien und zeigten eine hohe Biokompatibilität und Stabilität. Als multifunktionales theranostisches Nanokomposit wurde ICG aufgrund seiner PTT-PDT-Eigenschaften als NIR-Fluoreszenzbildgebungsmittel und Phototherapiemittel eingesetzt. Arte wurde hoch in die NPs geladen und durch NIR-Bestrahlung zur Chemotherapie freigesetzt. Geleitet von den Ergebnissen der NIR-Bildgebung wurde die hohe Wirkung der gezielten IGPC-Kombination sowohl in vitro als auch in vivo nachgewiesen. Gemäß unseren Ergebnissen glauben wir, dass FA-IHA-NPs ein potenziell vielseitiges Theranostikum für die kontrollierte Wirkstoffabgabe und die bildgebungsgesteuerte tumorgerichtete kombinatorische Photochemotherapie sein könnten.
Methoden
Materialien
N-(3-Dimethylaminopropyl)-N'-ethylcarbodiimidhydrochlorid (EDC), N-Hydroxysuccinimid (NHS) und Artesunat (Arte, ~99%) wurden von Sigma-Aldrich (USA) bezogen. 4', 6'-Diamidino-2-phenylindol (DAPI) und Cell Counting Kit-8 (CCK-8) wurden von Aladdin (Shanghai, China) bezogen. NH2 –PEG2000 –COOH und NH2 –PEG2000 -FA wurden von Xi’an Ruixi Biological Technology Co., Ltd. (Xi’an, China) gekauft. DMEM-Medien und Phosphatpuffer-Kochsalzlösung (PBS) wurden von Gibco BRL (NY, USA) bereitgestellt. Sulfo-NHS-Derivat von ICG (ICG-NHS) wurde von Dojindo Laboratories (Kumamoto, Japan) gekauft.
Synthese und Charakterisierung von FA-IHA-NPs
Artesunat wurde in DMSO gelöst und dann in 15 ml Wasser gegeben. 10 mg HSA-Pulver wurden in die obige Lösung gegeben und 3 h bei Raumtemperatur leicht gerührt. Nach dem Rühren wurde die Mischung durch Vernetzen mit 150 μL 0,5% Glutaraldehyd verarbeitet. Um die überflüssigen chemischen Reagenzien zu entfernen, wurde die Mischung 1 Tag lang gegen destilliertes Wasser (MW cut off = 8.000–12.000 Da) dialysiert, was zu Arte-beladenen HSA-Nanokompositen (Arte-HSA) führte.
Um die Carboxylgruppen von HSA zu aktivieren, wurden die chemischen Reagenzien EDC und NHS in die Arte-HSA-Lösung gegeben. Danach wurde die Mischung mit NH2 . umgesetzt –PEG2000 -FA für 3 h bei 4°С. Als nächstes wurde das ICG-NHS unter leichtem Rühren für 30 Minuten bei Raumtemperatur in die Mischung gegeben. Die gereinigten FA- und ICG-konjugierten HSA-Nanopartikel (FA-ICG-HSA@Arte, FA-IHA NPs) wurden durch Dialyse in entionisiertem Wasser für 24 Stunden erhalten. Die Menge an beladenem Arte und ICG wurde mit einem UV-Vis-Spektrophotometer nachgewiesen. Die Ladeeffizienz = W1 / W2 × 100 %, wobei W1 das Gewicht von Arte oder ICG in FA-IHA-NPs darstellt und W2 das Gewicht von Arte oder ICG hinzugefügt ist.
Zur Detektion der Morphologie der Proben wurde die Transmissionselektronenmikroskopie (Hitachi, Tokyo, Japan) verwendet. Ein Zetasizer (Zetasizer 3000; Malvern Instruments, Worcestershire, UK) wurde verwendet, um die Größe und das Zetapotential der Proben zu messen. Zur Messung der Absorptionsspektren wurde ein UV-Vis-Spektrophotometer (UV-1601PC, Shimadzu, Kyoto, Japan) verwendet. Der 808-nm-Einzelwellenlängen-Dauerstrichlaser (Beijing Laserwave Optoelectronics Technology Co. Ltd) wurde verwendet, um photothermische Experimente durchzuführen, und die Temperatur wurde mit einem Thermoelement-Thermometer (Fluke, USA) gemessen.
Thermische und pH-getriggerte Arte-Freisetzung
Um die thermische und pH-getriggerte Arte-Freisetzung zu bestimmen, wurden FA-IHA-NPs (50 μg/ml) in drei Gruppen eingeteilt:(a) pH 6,5, (b) pH 7,4 und (c) pH 6,5 mit NIR-Bestrahlung (808 .). nm, 1 W/cm 2 , 1 Minuten-Puls) zu ausgewählten Zeitpunkten während 36 Stunden. Die freigesetzte Arte-Menge wurde anhand der UV-Vis-Absorption von Arte bei 287 nm im Überstand bestimmt.
Nachweis der Singulett-Sauerstoffproduktion
1,3-Diphenylisobenzofuran (DPBF) wurde verwendet, um den Singulett-Sauerstoff nachzuweisen. 15 μl DPBF-Acetonitril-Lösung wurden zu reiner ICG- oder FA-IHA-NPs-Lösung (1,0 ml, 10 μg/ml) gegeben und gründlich gemischt, gefolgt von 5 Minuten Bestrahlung (808 nm, 1,0 W/cm 2 ). Die UV-Vis-Absorptionsspektren wurden zu verschiedenen Zeitpunkten aufgenommen und die Abnahmerate der Absorption bei 410 nm ist proportional zur Singulett-Sauerstoffproduktion.
Zellkultur und zelluläre Aufnahme
HepG2-Zellen wurden von der American Type Culture Collection und in 25 cm 2 . gekauft Zellkulturflasche mit DMEM-Kulturmedium durch Zugabe von 1% Penicillin-Streptomycin und 10% fötalem Rinderserum (FBS). HepG2-Zellen wurden bei 37 °C in einem 5 %igen CO2 . aufbewahrt Atmosphäre.
Um die zelluläre Aufnahme zu beobachten, wurden HepG2-Zellen mit freiem ICG, IHA-NPs und FA-IHA-NPs (mit 0,05 mg/ml ICG) für 6 h kultiviert. Danach wurde PBS verwendet, um die behandelten Zellen dreimal zu waschen. Die Zellen wurden dann mit 200 μL Glutaraldehyd fixiert und 10 Minuten mit DAPI gefärbt. Die Fluoreszenzsignale der Nanopartikel in Zellen wurden unter Verwendung eines konfokalen Laser-Scanning-Mikroskops (FV300, Olympus, Japan) nachgewiesen.
Um die zelluläre Aufnahme weiter zu bewerten, wurde ein Durchflusszytometer (FCM, BD, Franklin Lakes, NJ, USA) verwendet. Wie oben beschrieben, wurden die mit freien ICG-, IHA-NPs- und FA-IHA-NPs-behandelten Zellen dreimal mit PBS gewaschen und mit Trypsin-EDTA verdaut. Die suspendierten Zellen wurden direkt in FCM eingebracht, um das zelluläre Aufnahmeverhältnis zu analysieren.
Erzeugung intrazellulärer ROS
HepG2-Zellen wurden in 12-Well-Platten mit einer Dichte von 2 × 10 5 . kultiviert Zellen pro Milliliter und inkubiert für 24 h, gefolgt von der Zugabe von 1 ml verschiedener Proben, einschließlich (1) PBS, (2) Arte, (3) FA-HA-NPs, (4) freies ICG, (5) IHA- NPs und (6) FA-IHA-NPs-Lösung. Nach einer weiteren Inkubation für 12 h wurden die Zellen 5 min (808 nm, 1,0 W/cm 2 .) bestrahlt ), gefolgt von einer Behandlung mit DCFH-DA (5 μg/ml) für weitere 30 Minuten. Schließlich wurden die Zellen gründlich mit PBS gewaschen und die Produktion von intrazellulärem ROS wurde quantitativ mit einem Zytometer und qualitativ mit einer Leica-inversen Fluoreszenzmikroskopie nachgewiesen.
Kombinative In-vitro-Tumor-Photo-Chemotherapie
HepG2-Zellen wurden in 96-Well-Platten ausgesät (2 × 10 4 Zellen pro Well) für eine 24-stündige Inkubation. Freie ICG-, Arte-, IHA-NPs und FA-IHA-NPs (mit 0, 5, 10, 20 und 30 μg/ml Arte) wurden in die Zellen gegeben. Nach einer 6-stündigen Inkubation wurden die alten Medien verworfen. Die behandelten Zellen wurden mit oder ohne 808-nm-Laser bestrahlt (1,0 W/cm 2 , 5 min) und für die nächsten 24 h kultiviert. Die Lebensfähigkeit der Zellen wurde durch einen klassischen CCK-8-Assay gemäß dem Protokoll gemessen.
Um die lebenden und toten Zellen nach der NIR-Behandlung weiter zu bestätigen, wurden die behandelten Zellen mit Calcein-AM/PI mitgefärbt. HepG2-Zellen wurden in 35 mm-Platten mit einer Dichte von 1 × 10 6 . vorgeimpft Zellen pro Platte und wurden mit PBS, PBS + NIR, FA-IHA NPs oder FA-IHA NPs + NIR behandelt. Nach 6 Stunden Inkubation wurden die Zellen 5 Minuten lang mit einem 808 nm-Laser (1 W/cm 2 .) bestrahlt ) und für die nächsten 24 Stunden kultiviert. Die Zellen wurden 30 min mit Calcein-AM/PI gefärbt, mit PBS gewaschen, um überschüssige Farbstofflösung zu entfernen, und dann mit einem konfokalen Laserscanningmikroskop abgebildet (Calcein-AM lex = 488 nm, lem = 515 nm; PI lex = 535 nm , lem = 617 nm).
Tiermodell und In-vivo-Fluoreszenzbildgebung
Balb/c-Nacktmäuse wurden vom Center of Laboratory Animal Science der Provinz Guangdong bezogen und gemäß den von der Guangzhou Medical University genehmigten Protokollen verwendet. Um subkutane HepG2-Tumoren zu etablieren, 1 × 10 6 HepG2-Zellen (in 100 μl PBS) wurden in den Rücken einer nackten Balb/c-Maus injiziert.
Tumor tragende Mäuse (n = 5) wurden mit einem kommerziell erhältlichen IVIS Spectrum-System (Caliper LifeSciences, USA) vor und 10 min, 6 h, 12 h, 24 h und 48 h nach der intravenösen Injektion von freiem ICG, IHA-NPs und FA- IHA-NPs.
In-vivo-Tumor-Kombinations-Photo-Chemotherapie
Mäuse mit Tumoren wurden nach dem Zufallsprinzip in verschiedene Gruppen (n = 5) und wurden mit PBS, Arte, FA-IHA NPs, ICG + NIR, IHA NPs + NIR bzw. FA-IHA NPs + NIR (mit gleicher freier Arte-Dosis) behandelt. Fünf-Minuten-NIR-Laser (808 nm, 1 W/cm 2 ) wurde verwendet, um die Tumorregion 24 h (Tag 0) und 48 h (Tag 1) nach der intravenösen Injektion dieser Proben zu bestrahlen. Die Wärmebilder und die Temperatur der bestrahlten Mäuse wurden aufgezeichnet. Während der Behandlung wurde die Tumorgröße alle 4 Tage aufgezeichnet und nach folgender Gleichung berechnet:Volumen = (Tumorlänge) × (Tumorbreite) 2 / 2. Die Ergebnisse wurden durch das relative Tumorvolumen angezeigt, das das Tumorvolumen dividiert durch das anfängliche Tumorvolumen war. Nach der Behandlung wurden die wichtigsten Organe, einschließlich Herz, Leber, Milz, Lunge und Niere dieser Mäuse in PBS- und FA-IHA NPs + NIR-Gruppen entnommen, in 4% Formalin fixiert, in Paraffin eingebettet, mit H&E gefärbt und durch a . aufgezeichnet digitales Mikroskop.
Ergebnisse und Diskussion
Synthese und Charakterisierung von FA-IHA-NPs
Abbildung 1 veranschaulicht die schematische Verwendung von FA-IHA-NPs und ihre Anwendung für die bildgebungsgesteuerte tumorgerichtete kombinatorische Photochemotherapie. Die multifunktionalen Theranostikum FA-IHA NPs wurden durch eine einfache und biokompatible Selbstorganisationsmethode hergestellt. Das konjugierte ICG wurde aufgrund seiner PTT-PDT-Eigenschaften als NIR-Fluoreszenzbildgebungsmittel und Phototherapiemittel verwendet. Außerdem übte das belastete Arte die chemotherapeutische Wirkung aus.
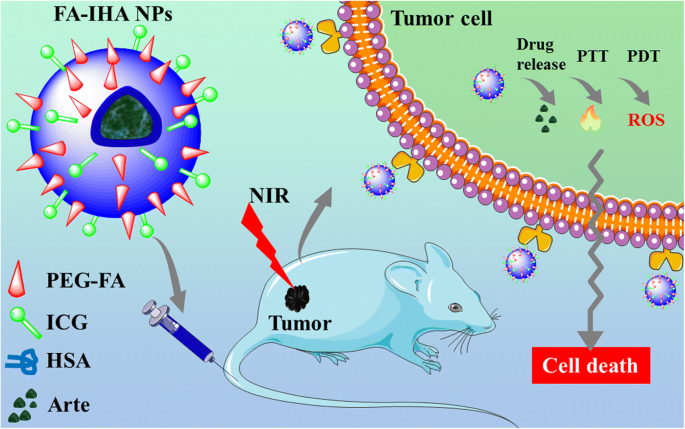
Schematische Darstellung der Verwendung von FA-IHA-NPs für die bildgebungsgesteuerte tumorgerichtete kombinatorische Photochemotherapie in vitro und in vivo
Das TEM-Bild von FA-IHA-NPs zeigt eine monodisperse kugelförmige Struktur mit einem Durchmesser von ungefähr 131,2 nm (Abb. 2a). Dieser hydrodynamische Durchmesser wurde in Wasser, Phosphatpuffer-Kochsalzlösung (PBS) und Zellmedium (Abb. 2b) gemäß DLS-Analyse als 131 ± 2,3 nm lang bestätigt. Das Zetapotential von 131,2 ± 2,12 wurde in diesen drei Medien auch als − 29,2 ± 1,13 mV nachgewiesen (Abb. 2c). Darüber hinaus hatte sich der Durchmesser der FA-IHA-NPs in diesen drei Medien über 7 Tage nicht signifikant verändert (Abb. 2d). Diese Ergebnisse zeigten, dass die hergestellten FA-IHA-NPs eine gute Stabilität aufwiesen, wahrscheinlich aufgrund der PEG- und HSA-Beschichtung. Das UV-vis-NIR-Spektrum von FA-IHA-NPs zeigte den Absorptionspeak von Arte und ICG (Abb. 2e), was die Existenz von Arte und ICG in FA-IHA-NPs belegt. Das Arte-Belastungsverhältnis betrug 98,6 ± 3,1 % und das ICG-Belastungsverhältnis 56,9 ± 2,4 %. Abbildung 2f zeigt, dass die FA-IHA-NPs im Vergleich zu freiem ICG eine ähnliche Fluoreszenzeigenschaft aufwiesen.
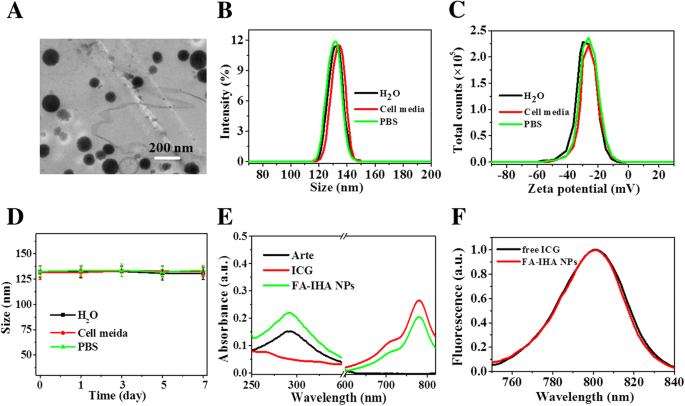
a TEM-Aufnahme von FA-IHA-NPs. b , c Größen- und Zetapotentialverteilung von FA-IHA-NPs in Wasser, Zellmedium und PBS. d Größenänderung von FA-IHA-NPs in Wasser, Zellmedium und PBS. e Absorptionsspektren von freien ICG-, Arte- und FA-IHA-NPs. f Fluoreszenzspektren von freien ICG- und FA-IHA-NPs
Ermutigt durch die starke optische NIR-Absorption von FA-IHA-NPs wurde die photothermische Eigenschaft von FA-IHA-NPs bewertet. Wasser, freies ICG und FA-IHA-NPs (mit gleicher ICG-Konzentration) wurden mit einem 808 nm-Laser (1 W/cm 2 .) bestrahlt ). Die Temperatur der FA-IHA-NPs und des freien ICG stieg innerhalb von 5 Minuten der Bestrahlung um etwa 36 °C an (Abb. 3a), während Wasser einen Temperaturanstieg von weniger als 4 °C ergab, was zeigt, dass die ICG-enthaltenden Nanopartikel eine signifikante photothermische Wirkung und haben das Potenzial zur Krebstherapie. Zusätzlich Datei 1:Abbildung S1 zeigt die photothermischen Erwärmungskurven von FA-IHA-NPs unter 5 Minuten einer 808 nm-Laserbestrahlung mit 0,5, 1 und 1,5 W/cm 2 , was darauf hinweist, dass die optimale Laserintensität 1 W/cm 2 . beträgt . Die Photostabilitätstests an FA-IHA-NPs und freiem ICG wurden durchgeführt. Freies ICG zeigte nach fünf Zyklen eine signifikante Temperaturabnahme im Vergleich zu FA-IHA-NPs (Abb. 3b). Abbildung 3c zeigt die Änderung der Absorptionsintensität von freien ICG- und FA-IHA-NPs vor und nach fünf Zyklen NIR-Bestrahlung (808 nm, 1 W/cm 2 ). Die Ergebnisse legten nahe, dass die Absorptionsintensität bei 808 nm von freiem ICG nach fünf Zyklen NIR-Bestrahlung abnahm, während FA-IHA-NPs die ursprüngliche Absorptionsintensität beibehielten. Darüber hinaus verglichen wir die Fluoreszenzstabilität von freien ICG- und FA-IHA-NPs (Abb. 3d). Nach 30 Tagen Lagerung bei 4 °C betrug die Fluoreszenzintensität von FA-IHA-NPs bei 800 nm 0,72 im Vergleich zu seiner Anfangsintensität von 1, während die Fluoreszenz von freiem ICG aufgrund der induzierten Aggregation auf 0,12 im Vergleich zu seiner Anfangsintensität sank -Photobleichen [36]. Diese Ergebnisse zeigten, dass das kovalent konjugierte ICG stabiler war als das freie ICG, wahrscheinlich aufgrund der HSA- und PEG-Selbstorganisation, die ICG vor einer durch die innere Umgebung induzierten Aggregation wie Hitze oder Licht schützt. Somit legen diese Ergebnisse nahe, dass FA-IHA-NPs eine ausgezeichnete photothermische Wirkung und photothermische Stabilität aufweisen.
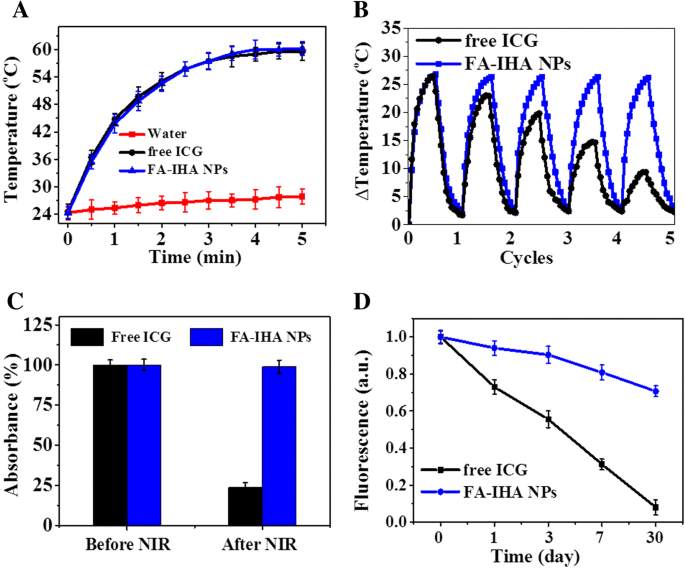
a Photothermische Heizkurven von Wasser, ICG und FA-IHA-NPs unter 5 Minuten 808 nm Laserstrahlung (1 W/cm 2 .) ). b Temperaturschwankungen von ICG- und FA-IHA-NPs nach 5 Minuten kontinuierlicher Bestrahlung mit einem 808 nm-Laser für 5 Zyklen. c Die Absorptionsänderung von FA-IHA-NPs bei 780 nm vor und nach Bestrahlung mit einem 808 nm NIR-Laser für 5 Zyklen. d ICG- und FA-IHA-NPs-Fluoreszenzänderung über 30 Tage
Als nächstes wurde eine ROS-spezifische Sonde 1,3-Diphenylisobenzofuran (DPBF) verwendet, um die ROS-Produktion durch FA-IHA-NPs nach NIR-Bestrahlung nachzuweisen. Wie in Abb. 4a gezeigt, produzierten FA-IHA-NPs eine signifikante ROS-Menge (0,58 in der Standardabsorption) innerhalb von 5 Minuten nach NIR-Bestrahlung im Vergleich zu freiem ICG (0,35), was auf die Kombinationstherapie mit FA-IHA-NPs zurückgeführt werden könnte.
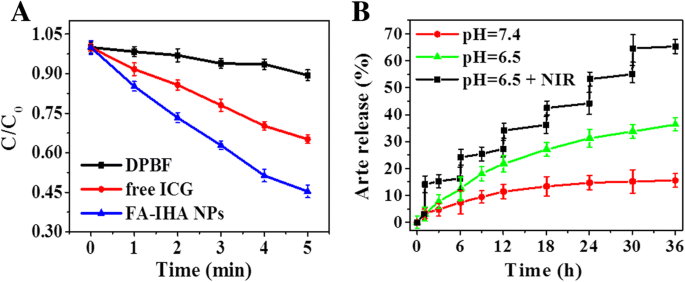
a Normalisierte DPBF-Absorption in Gegenwart von ICG, FA-IHA-NPs und Blindprobe unter 808-nm-Laserbestrahlung (1 W/cm 2 .) ). b Freisetzungskinetik von Arte aus FA-IHA-NPs unter pH = 7.4 und pH = 6.5 mit bzw. ohne NIR-Laserbestrahlung
Unter NIR-Laserbestrahlung (808 nm, 1 W/cm 2 ) und pH-Bedingung wurde die Freisetzungsleistung untersucht (Abb. 4b). Im Gegensatz dazu zeigten FA-IHA-NPs ohne NIR-Bestrahlung 11,61 % und 34,2 % Arte-Freisetzung bei pH 7,4 bzw. pH 6,5, während FA-IHA-NPs unter sechsmaliger NIR-Bestrahlung insgesamt 68,4 % Arte-Freisetzung bei . zeigten pH 6,5, was darauf hindeutet, dass NIR-Bestrahlung und saure Bedingungen beide die Arte-Freisetzung aus FA-IHA-NPs signifikant auslösen könnten. Die NIR-Bestrahlung und die auf Säure ansprechende Wirkstofffreisetzung waren wahrscheinlich auf die wärmeinduzierte Expansion von HSA-Nanopartikeln zurückzuführen, und darüber hinaus, in einer sauren Umgebung, auf das H + könnte die Oberflächenladung von HSA verändern, was das hydrophile/hydrophobe Gleichgewicht der Nanopartikel verändert [37, 38].
Zellaufnahme und Nachweis von intrazellulärem ROS
Dank der ICG-Fluoreszenzeigenschaften wurde die Aufnahme von FA-IHA-NPs in HepG2-Zellen durch ein Fluoreszenzmikroskop direkt beobachtet. Wie in Abb. 5a gezeigt, zeigte das Zytoplasma nach Behandlung der Zellen mit FA-IHA-NPs eine stärkere rote ICG-Fluoreszenz als bei Zellen, die mit freiem ICG und IHA-NPs behandelt wurden. Darüber hinaus wurde das Verhältnis der FA-IHA-NPs-Zellaufnahme von FCM mit 52,3 % quantifiziert, was höher war als das von IHA-NPs (25,2 %) und freiem ICG (3,9 %) (Abb. 5b). Die Ergebnisse zeigten, dass die konjugierten FA es den Nanopartikeln ermöglichten, auf die FA-Rezeptoren auf Tumorzellen abzuzielen und somit die Aufnahme von FA-IHA-NPs in die Zellen zu verbessern [39, 40, 41].
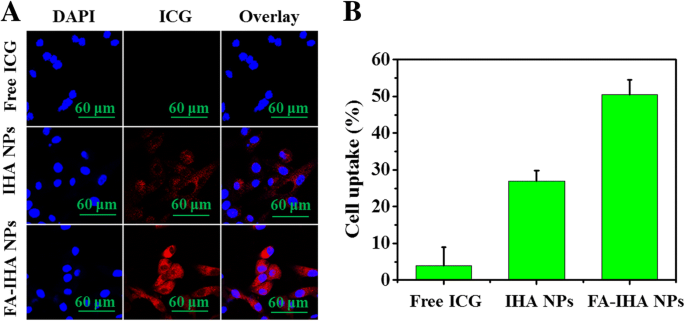
a Konfokale Fluoreszenzbilder von HepG2-Zellen nach Inkubation mit freien ICG- und IHA-NPs und FA-IHA-NPs. Rote und blaue Farben repräsentieren die ICG-Fluoreszenz bzw. DAPI-gefärbte Zellkerne. b Durchflusszytometrie-Messung der ICG-Fluoreszenzintensitäten in HepG2-Zellen nach Inkubation mit freien ICG- und IHA-NPs und FA-IHA-NPs
Unter Verwendung eines Fluoreszenzmikroskops beobachteten wir die intrinsische photodynamische Aktivität von Arte-, ICG- und FA-IHA-NPs-behandelten Zellen mit oder ohne NIR-Bestrahlung. Eine ROS-Sonde 2,7-Dichlordihydrofluoresceindiacetat wurde verwendet, um die zelluläre ROS-Produktion sichtbar zu machen. Die Ergebnisse zeigten, dass FA-IHA-NPs im Vergleich zu anderen Proben nach 5 Minuten NIR-Bestrahlung eine signifikant erhöhte ROS-Produktion induzieren konnten (Abb. 6a). Die entsprechenden Fluoreszenzwerte sind in Abb. 6b dargestellt.
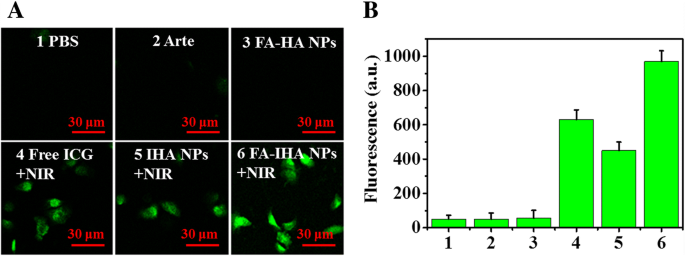
a Fluoreszenzbilder der ROS-Produktion in Krebszellen, die mit verschiedenen Medikamenten behandelt wurden, und b entsprechende Fluoreszenzintensität:(1) PBS, (2) Arte, (3) FA-HA NPs, (4) freies ICG + NIR, (5) IHA NPs + NIR und (6) FA-IHA NPs + NIR
In-vitro-Tumor-Kombinations-Photo-Chemotherapie
Abbildung 7a zeigt die Temperaturänderung der mit PBS-, freien ICG-, IHA-NPs- und FA-IHA-NPs-behandelten Zellen (mit gleicher ICG-Konzentration) nach 5 min NIR-Bestrahlung (1,0 W/cm 2 ). Die Temperatur der mit FA-IHA-NPs behandelten Zellen zeigte den höchsten Anstieg (ΔT = 31 °C) im Vergleich zu PBS-, freien ICG- und IHA-NPs-behandelten Zellen. Die Lebensfähigkeit von Zellen, die mit Arte, IHA-NPs und FA-IHA-NPs in unterschiedlichen Konzentrationen für 24 Stunden ohne NIR-Bestrahlung behandelt wurden, nahm mit steigender Konzentration ab, während freies ICG bei diesen Konzentrationen keine Zytotoxizität zeigte (Abb. 7b). In der Zwischenzeit zeigten die Wirkstoffträger FA-IH NPs (FA-IHA NPs ohne Arte) ebenfalls keine signifikante Zytotoxizität (zusätzliche Datei 1:Abbildung S2). Im Gegensatz dazu nach NIR-Bestrahlung (1,0 W/cm 2 , 5 min) wurde ein signifikanter konzentrationsabhängiger Zelltod in Zellen beobachtet, die mit freiem ICG, IHA-NPs und FA-IHA-NPs behandelt wurden (Fig. 7c). Der Effekt war bei mit FA-IHA NPs behandelten Zellen besonders signifikant. Die ausgezeichnete Antikrebswirkung könnte auf die gezielte kombinatorische Photochemotherapie, wie die chemotherapeutische Wirkung des freigesetzten Arte und die therapeutische PTT-PDT-Wirkung von ICG, zurückgeführt werden. Darüber hinaus wurde die Zytotoxizität von FA-IHA-NPs mit oder ohne NIR-Bestrahlung durch Calcein-AM/PI-Doppelfärbung untersucht. Mit FA-IHA-NPs und Bestrahlung behandelte Zellen waren im Vergleich zu anderen behandelten Gruppen fast vollständig tot (Abb. 7d).
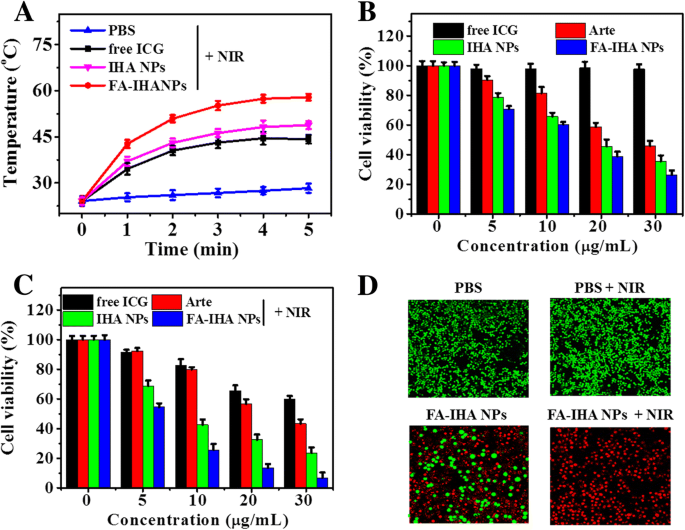
a Temperaturänderungskurven von PBS-, freien ICG-, IHA-NPs- und FA-IHA-NPs-behandelten Zellen in 96-Well-Platten nach 5 min NIR-Bestrahlung. b, c Zelllebensfähigkeit von Zellen, die mit freiem ICG, Arte, IHA-NPs und FA-IHA-NPs ohne oder mit 808-nm-Laserbestrahlung (5 min, 1 W/cm 2 .) behandelt wurden ), bzw. d Calcium AM/PI Dual-Färbung Bilder von Zellen nach Behandlung mit PBS (Kontrolle), PBS + NIR, FA-IHA NPs bzw. FA-IHA NPs + NIR
In-vivo-Fluoreszenzbildgebung
Wie in Abb. 8a und b gezeigt, war 0,1 h nach der Injektion von freiem ICG, IHA-NPs und FA-IHA-NPs im gesamten Körper der tumortragenden Mäuse ein starkes Fluoreszenzsignal zu sehen. Die Fluoreszenzsignale nahmen in der Tumorregion mit zunehmender Zeit zu und erreichten den Höhepunkt 24 h nach der Injektion. Die Tumorfluoreszenzsignale in der FA-IHA-NPs-Gruppe waren im Vergleich zu denen der ICG- und IHA-NPs-Gruppen an allen getesteten Punkten am höchsten (Abb. 8b), was darauf hindeutet, dass sich FA-IHA-NPs aufgrund des FA . stark in der Tumorregion anreichern könnten -induzierte tumorgerichtete Wirkung. Darüber hinaus wurde die Bioverteilung in wichtigen Geweben, einschließlich Herz, Leber, Milz, Lunge und Nieren, 24 h nach der Injektion durch eine quantitative Ex-vivo-Fluoreszenzanalyse durchgeführt. In allen getesteten Gruppen wurden im Lebergewebe starke Fluoreszenzsignale nachgewiesen (Abb. 8c), was darauf hindeutet, dass die metabolische Hauptumwandlung dieser Verbindungen einem hepatischen Weg folgt. Diese Ergebnisse zeigten, dass sich FA-IHA-NPs selektiv in Tumoren in vivo anreichern könnten, wahrscheinlich induziert durch die auf FA gerichtete Wirkung [37].
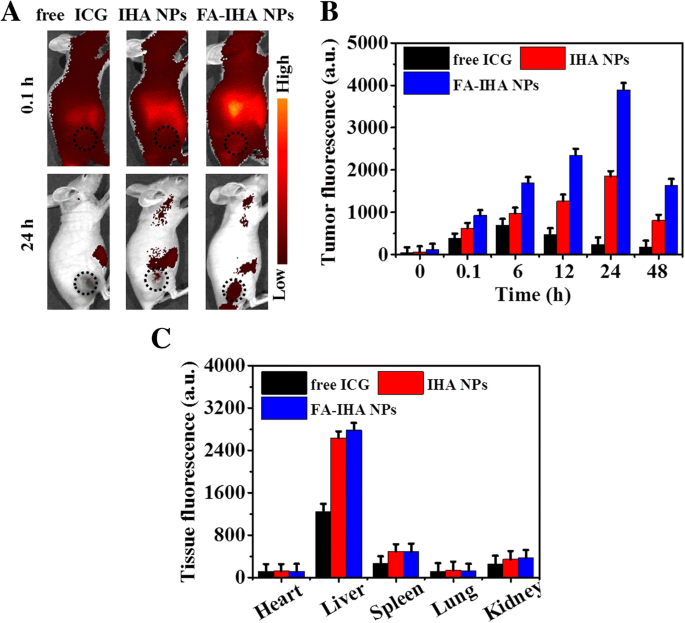
a Repräsentative Fluoreszenzbilder von tumortragenden Mäusen nach Schwanzveneninjektion mit freiem ICG, IHA-NPs und FA-RIPNPs. Die schwarzen gestrichelten Kreise zeigen die Tumorregion an. b Quantitative in vivo-Analyse des Fluoreszenzsignals in den Tumorregionen von Mäusen, die mit freiem ICG, IHA-NPs und FA-IHA-NPs behandelt wurden, als Funktion der Injektionszeit. c Das Fluoreszenzsignal wichtiger Organe wie Herz, Leber, Milz, Lunge und Niere
In-vivo-Tumor-Kombinations-Photo-Chemotherapie
Wie in Abb. 9a und b gezeigt, ist die Tumortemperatur bei den tumortragenden Mäusen nach Behandlung mit PBS, freiem ICG, IHA-NPs und FA-IHA-NPs 24 h nach der Injektion unter 5 Minuten NIR-Bestrahlung (1 W/ cm 2 ) wurde mit einer Wärmebildkamera aufgenommen. In der mit FA-IHA-NPs behandelten Gruppe wurde ein Anstieg der Tumorregion um ungefähr 22,1 °C festgestellt, der am höchsten war als der der anderen Gruppen. Nach zwei Zyklen NIR-Bestrahlung (Tag 0 und Tag 2) zeigte die FA-IHA NPs + NIR-Gruppe eine signifikante Suppression des Tumorwachstums ohne Rückfall (Abb. 9c), während die mit PBS, Arte, FA-IHA NPs behandelten Gruppen, PBS + NIR, ICG + NIR und IHA NPs + NIR zeigten keinen klaren Hinweis auf eine Tumorsuppression. Darüber hinaus zeigten die Mäuse in der FA-IHA NPs + NIR-Gruppe nach 90 Tagen eine Überlebensrate von 100 % (Fig. 9d). Diese Ergebnisse zeigen, dass FA-IHA-NPs mit NIR-Bestrahlung eine ausgezeichnete in-vivo-Tumortherapiewirksamkeit aufwiesen, wahrscheinlich aufgrund einer aktiven zielgerichteten und kombinierten Photochemotherapie.
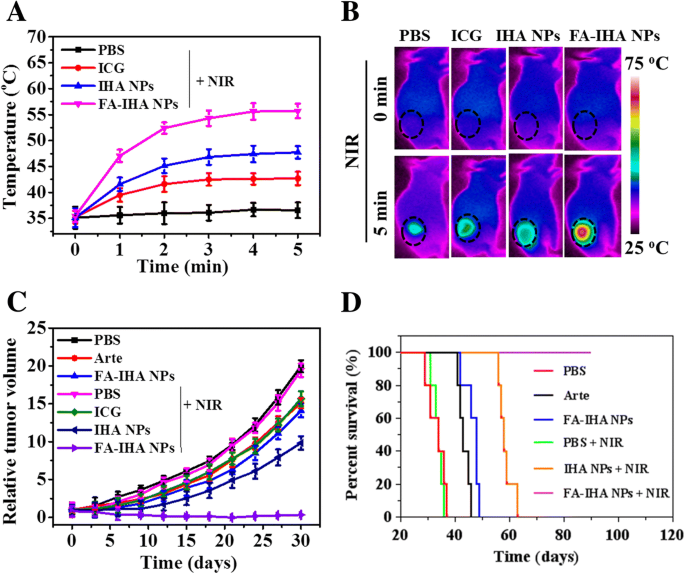
a Tumorregionstemperaturen bei tumortragenden Mäusen nach Injektion von PBS, ICG, IHA-NPs und FA-RIPNPs in die Schwanzvene nach 24 Stunden unter 5 Minuten NIR-Bestrahlung (808 nm, 1 W/cm 2 .) ). b Wärmebilder von tumortragenden Mäusen nach Injektion von PBS, ICG, IHA-NPs und FA-RIPNPs in die Schwanzvene bei 24 Stunden unter 5 Minuten NIR-Bestrahlung (808 nm, 1 W/cm 2 .) ). c Wachstumsprofil von HepG2-Xenotransplantat-Tumoren nach intravenöser Injektion von PBS, Arte, ICG, IHA-NPs und FA-RIPNPs mit oder ohne 5 min NIR-Bestrahlung (808 nm, 1 W/cm 2 ). d Überlebensrate tumortragender Mäuse nach Injektion in die Schwanzvene mit PBS, freiem Arte, ICG, IHA-NPs und FA-RIPNPs mit oder ohne 5 min NIR-Bestrahlung (808 nm, 1 W/cm 2 )
Schließlich wurde die Hämatoxylin- und Eosin-(H&E)-Färbung verwendet, um die Toxizität von FA-IHA-NPs zu bewerten. Die Schnittbilder zeigten keine signifikanten histologischen Läsionen im Vergleich zu der mit PBS behandelten Gruppe (Abb. 10), was darauf hindeutet, dass FA-IHA-NPs eine vernachlässigbare Toxizität aufwiesen, die wahrscheinlich auf die Sicherheit der Inhaltsstoffe der FA-IHA-NPs zurückzuführen war und somit von Vorteil war für ihre zukünftige Verwendung in der klinischen Praxis.
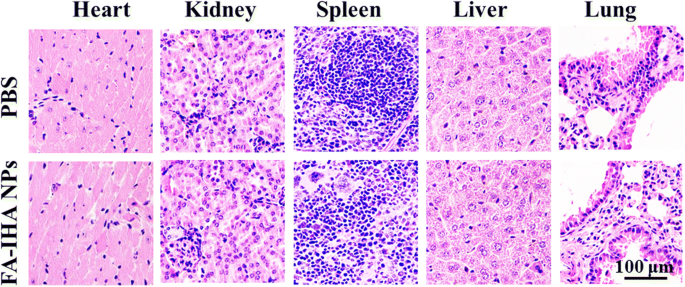
H&E-gefärbte Gewebeschnitte wichtiger Organe, einschließlich Herz, Leber, Milz, Lunge und Niere von Mäusen, die mit PBS und FA-IHA NPs behandelt wurden
Schlussfolgerungen
Zusammenfassend wurde ein multifunktionales Theranostikum hergestellt, das FA und ICG kovalent konjugiert und Arte für die bildgebungsgesteuerte tumorgerichtete kombinatorische Photochemotherapie in vitro und in vivo einkapselt. Die präparierten FA-IHA-NPs zeigten ausgezeichnete Kolloid- und Hitzestabilität und Fluoreszenzeigenschaft. Unter NIR-Bestrahlung zeigten FA-IHA-NPs einen großartigen photothermischen Effekt, der die Arte-Freisetzung auslösen und nach NIR-Bestrahlung viel mehr ROS produzieren könnte als freies ICG, das photodynamische Leistung aufwies. Die konjugierten FA erleichterten in vitro und in vivo eine hocheffiziente zelluläre Aufnahme und Tumorakkumulation. Darüber hinaus wurde die hochwirksame Antikrebswirksamkeit von FA-IHA-NPs in Kombination mit einer aktiven zielgerichteten thermischen medikamentösen Chemotherapie wie der PTT-PDT-Therapie in vitro und in vivo nachgewiesen. Insgesamt deuteten die erhaltenen Ergebnisse darauf hin, dass FA-IHA-NPs ein vielversprechendes auf Tumore ausgerichtetes System sein könnten, das für zukünftige Anwendungen in der Nanomedizin geeignet ist.
Abkürzungen
- Arte:
-
Artesunat
- FA:
-
Folsäure
- HSA:
-
Humanserumalbumin
- ICG:
-
Indocyaningrün
- NIR:
-
Nahes Infrarot
- PDT:
-
Photodynamische Therapie
- PEG:
-
Polyethylenglykol
- PTT:
-
Photothermische Therapie
Nanomaterialien
- Herstellung und Bildgebung von Cyclocarbon
- Nanopartikel für die Krebstherapie:Aktuelle Fortschritte und Herausforderungen
- Herstellung und magnetische Eigenschaften von kobaltdotierten FeMn2O4-Spinell-Nanopartikeln
- Resveratrol-beladene Albumin-Nanopartikel mit verlängerter Durchblutung und verbesserter Biokompatibilität für eine hochwirksame gezielte Pankreastumortherapie
- Neuartige biokompatible Au-Nanostars@PEG-Nanopartikel für die In-vivo-CT-Bildgebung und renale Clearance-Eigenschaften
- Synthese und In-vitro-Leistung von polypyrrolbeschichteten Eisen-Platin-Nanopartikeln für die Photothermie und die photoakustische Bildgebung
- Wirkung des sauren Peptisierungsmittels auf das Anatas-Rutil-Verhältnis und die photokatalytische Leistung von TiO2-Nanopartikeln
- Magnetischer Goldnanopartikel-markierter monoklonaler Heparanase-Antikörper und seine anschließende Anwendung für die Tumor-Magnetresonanztomographie
- Unterkühlung von Wasser durch Nanopartikel und Ultraschall gesteuert
- Mit Curcumin beladene Chitosan-Rinderserumalbumin-Nanopartikel verstärken möglicherweise die Aβ-42-Phagozytose und die modulierte Makrophagen-Polarisation bei der Alzheimer-Krankheit



