Hocheffiziente Synthese von kohlenstoffbasierten Molybdänphosphid-Nanopartikeln für die elektrokatalytische Wasserstoffentwicklung
Zusammenfassung
Molybdänphosphid in Übergangsmetallphosphiden wird als attraktiver Elektrokatalysator für die Wasserstoffentwicklungsreaktion (HER) angesehen. Seine unbefriedigende Stabilität und Leitfähigkeit in alkalischer Umgebung hat jedoch seine Entwicklung gebremst. Hier führten wir erfolgreich N, C-codotierte MoP (MoP-NC)-Nanopartikel durch eine einfache und effiziente zweistufige Synthesemethode unter Verwendung von Harnstoff als Kohlenstoffquelle in das Molybdänphosphidsystem ein. Die Billigkeit von Harnstoff und das ausgezeichnete Verhältnis von Kohlenstoff zu Stickstoff beseitigen die Hindernisse vor der Entwicklung von MoP-NC-Verbundwerkstoffen. Die erhaltenen Komposite weisen eine ausgezeichnete elektrokatalytische HER-Aktivität und Stabilität in 1-M Kaliumhydroxid (KOH)-Lösung auf, die nur eine Überspannung von 131 mV erfordert, um eine Stromdichte von 10 mA cm −2 . zu erreichen und weist nach 1000 CV-Zyklen einen vernachlässigbaren Leistungsabfall auf.
Hintergrund
Die rasante Entwicklung des Menschen hat in den letzten Jahren zu einer allmählichen Erschöpfung der fossilen Energie geführt [1,2,3]. Daher suchen Forscher nach einer umweltfreundlichen Energiequelle, um diesen Teufelskreis einzudämmen, damit Wasserstoff auf dem Energiethron gehalten werden kann. Die traditionelle Photolyse und Elektrolyse von Wasser zur Herstellung von Wasserstoff befinden sich jedoch in einem schwierigen Effizienzengpass. Während die Menschen mit der Einführung hocheffizienter elektrolysierter wasserkatalysierter Wasserstofferzeugungskatalysatoren einen qualitativen Sprung in der Massenproduktion von Wasserstoff gemacht haben. Dieser katalysatorvermittelte elektrokatalytische Prozess erfordert, dass der Katalysator selbst ein niedriges Überpotential der Wasserstoffentwicklungsreaktion (HER) aufweist. Obwohl Edelmetalle wie Pt in diesem Stadium ein extrem niedriges Überpotential und eine ausgezeichnete Stabilität aufweisen, sind sie teuer [4,5,6]. Die Knappheit an verfügbarem Boden schränkt die großtechnische Anwendung solcher Katalysatoren ein [7,8,9]. Daher war die Suche nach einem Material mit geringen Kosten und relativ guter elektrokatalytischer Wasserstoffentwicklung in den letzten Jahren ein Brennpunkt [10,11,12,13].
Es ist erwähnenswert, dass Forscher kürzlich herausgefunden haben, dass einige Nichtedelmetall-Katalysatoren ein gutes Preis-Leistungs-Verhältnis in Richtung Wasserstoffentwicklung aufweisen, darunter das am häufigsten verwendete Molybdänphosphid (MoP) in Übergangsmetallphosphiden (TMPs) [14 ,15,16,17]. Sonneet al. gemischt (NH4 )6 Mo7 O24 ·4H2 O, (NH4 )2 HPO4 und Zitronensäure (CA) in verschiedenen Molverhältnissen, wenn Mo:P:CA =1:1:x und x =2, die Bildung von vernetzten Netzwerkstruktur-MoP-Nanopartikeln haben die beste HER-Leistung [18]. Joshuaet al. stellten amorphe MoP-Nanopartikel mit guten HER-Eigenschaften durch Erhitzen von Hexacarbonylmolybdän und Trioctylphosphin (TOP) her [19]. Die Leitfähigkeit von reinem Molybdänphosphid ist jedoch nicht zufriedenstellend, und die Wasserstoffentwicklungsleistung und -stabilität in einer alkalischen Lösung sind nicht so gut wie in einer sauren Umgebung, so dass die Leitfähigkeit und Stabilität durch die Einführung eines Materials auf Kohlenstoffbasis verbessert werden können [ 20,21,22].
Wir erreichten eine hocheffiziente zweistufige Synthese durch die Einführung von Harnstoff als Kohlenstoffquelle in das Molybdänphosphidsystem und stellten erfolgreich N,C-codotierte MoP (MoP-NC)-Nanopartikel her, die eine ausgezeichnete katalytische Aktivität und Stabilität selbst in alkalischen Elektrolyten aufweisen . Darüber hinaus entwarfen wir zwei Kontrollgruppen, die die Wirkung von Harnstoff untersuchten, einschließlich keiner Kohlenstoffquelle und Glukose anstelle von Harnstoff als Kohlenstoffquelle. Interessanterweise ist ersteres immer schwächer als letzteres, wenn Glucose bzw. Harnstoff als Kohlenstoffquelle verwendet wird. Dies kann der Rolle von Harnstoff als Kohlenstoffquelle und Stickstoffquelle für die Hilfssynthese von Molybdänphosphid zugeschrieben werden [23].
Präsentation der Hypothese
Molybdänphosphid wird häufig als Nichtedelmetall-Katalysator in Richtung der Wasserstoffentwicklung verwendet. Die Einführung einer Kohlenstoffquelle kann die Leitfähigkeit und Stabilität des Elektrokatalysators verbessern. Die Einführung einer Stickstoffquelle kann die Leistung der Wasserstoffentwicklung in einer alkalischen Lösung verbessern.
Testen der Hypothese
Materialien
Harnstoff (CH4 N2 O), Glukose (C6 .) H12 O6 ), Ammoniumdihydrogenphosphat (NH4 .) H2 PO4 ) und Ammoniumheptamolybdat ((NH4 )6 Mo7 O24 ·4H2 O) wurden von Sinopharm Chemical Reagent Co., Ltd. bezogen. KOH wurde von Aladdin Ltd. in Shanghai bezogen. Im Experiment verwendete entionisiertes Wasser stammte aus einer Reinstwasserausrüstung.
Probenvorbereitung
In der typischen Synthese von MoP-NC, (NH4)6 Mo7 O24 ·4H2 O (0,240 g), NH4 H2 PO4 (0,167 g) und CO(NH2 )2 (2.000 µg) wurden in 50 µl entionisiertem Wasser gelöst und einer 15-minütigen Beschallung unterzogen. Danach wurde die resultierende Lösung auf 80 °C erhitzt und 90 min magnetisch gerührt, blieb während der gesamten Reaktion relativ geschlossen und wurde dann in einem Gefriertrockner getrocknet. Das erhaltene weiße Vorläuferpulver wurde von Raumtemperatur auf 900°C mit einer Geschwindigkeit von 5°C/min unter einem N2 erhitzt Atmosphäre für 120 min. Um den Einfluss der Kohlenstoffquelle auf die Materialsynthese zu untersuchen, wurde MoP-C hergestellt, indem Glucose anstelle von Harnstoff als Kohlenstoffquelle verwendet wurde. Wenn keine Kohlenstoffquelle oder Phosphorquelle hinzugefügt wurde, wurden Bulk-MoP bzw. Mo-NC hergestellt.
Charakterisierungen
Die Röntgenbeugungsinformationen (XRD) wurden mit einer Röntgenbeugung (XRD, Bruker D8-Advance-Diffraktometer mit Cu-Kα-Strahlung (λ =1,54056 Å)). Die Mikrostruktur der Probe wurde durch Feldemissions-Rasterelektronenmikroskopie (FE-SEM, S-4800, Hitachi, Japan) erhalten. Die TEM-Bilder wurden mit einem Transmissionselektronenmikroskop (TEM, JEM-2100, JEOL, Japan) durchgeführt. Die chemischen Komponenten wurden durch eine Röntgen-Photoelektronen-Spektroskopie (XPS) mit Mg Kα als monochromatischer Röntgenquelle analysiert.
Elektrochemischer Test
Alle elektrochemischen Messungen wurden an einer elektrochemischen Workstation (CHI 660E Chenhua, Shanghai) durchgeführt, die mit einem herkömmlichen Drei-Elektroden-System eines Pine Modulated Speed Rotators (PINE, USA) ausgestattet war. Der Pt-Draht und die gesättigte Kalomelelektrode (SCE) entsprachen der Gegenelektrode bzw. der Referenzelektrode, und die Glaskohlenstoffelektrode und die Drehscheibenvorrichtung wurden als Arbeitselektrode verbunden. Außerdem wurde 1 µM KOH-Elektrolyt zum Testen bereitgestellt. Die Arbeitselektrode wurde wie folgt hergestellt:Zuerst wurden 5 µl des Katalysators in einer Lösung gelöst, die mit 350 µl Isopropanol, 650 µl entionisiertem Wasser und 50 µl 5 Gew.-% Nafion vermischt war. Nachdem die oben erwähnte gemischte Lösung 30 Minuten lang mit Ultraschall behandelt worden war, wurde eine gleichförmig dispergierte Tinte erhalten. Schließlich wurden 10 &mgr;l der Tinte auf eine Glaskohlenstoffelektrode (Durchmesser 5 mm) für eine natürliche Lufttrocknungsbehandlung getropft, wobei der Katalysator eine Flächendichte von 0,485 mg &mgr; . Um die Leistungsparameter der Probe besser zu beschreiben, haben wir zum Vergleich einen Pt/C-Katalysator (20 Gew.-%) verwendet, und das Herstellungsverfahren war das gleiche wie bei der obigen Arbeitselektrode. Eine Sweep-Geschwindigkeit von 10 mV s −1 wurde für Messungen der Linear-Sweep-Voltammetrie (LSV) verwendet. Tafel wurde durch Anpassen der entsprechenden Bereichskurve gemäß der Tafel-Gleichung erhalten, und die elektrochemische Stabilität wurde durch Ausführen von 1000 Zyklen mit einer Durchlaufgeschwindigkeit von 100 mV·S −1 . erhalten . Die Doppelschichtkapazität (C dl ) Daten werden aus der zyklischen Voltammetrie (CV) abgeleitet, die im gleichen Spannungsbereich (0,847–0,947 V vs. RHE) bei unterschiedlichen Abtastratenbereichen (20–200 mV) durchgeführt wird. Messungen der elektrochemischen Impedanzspektroskopie (EIS) wurden bei einer konstanten Potentialamplitude von 10 mV über den Standardfrequenzbereich (1–10 5 Hz).
Implikationen der Hypothese
Abbildung 1a zeigt, dass das XRD-Muster von MoP-NC Beugungspeaks bei 27,95, 32,17, 43,15, 57,48, 57,95, 64,93, 67,03, 67,86 und 74,33 aufweist, entsprechend den neun verschiedenen Kristallflächen von MoP. SEM-Bilder von MoP-NC zeigten amorphe Mikrostrukturen kleiner Partikel (Abb. 1b). Die Partikel sammelten sich zu kleinen Clustern, aber es gab immer noch eine gewisse Lücke zwischen den Clustern. Aufgrund dieser kleinen und dichten Struktur haben MoP-NC sowohl eine beträchtliche katalytische Aktivität als auch eine gute Stabilität (Abb. 1c). Aus TEM und hochauflösendem TEM (HRTEM) (Abb. 1d, e) ist ersichtlich, dass diese Nanopartikel deutliche Gittersäume aufwiesen, wie z. B. Gittersäume aus der (100)-Ebene mit einem Abstand von 0.28 nm. Darüber hinaus befanden sich außerhalb dieser wohldefinierten Gitterrandbereiche MoP-NC-Nanopartikelkanten, die den Einbau von MoP-NC-Nanopartikeln in die Kohlenstoffmatrix stark unterstützten. Das entsprechende EDS-Element-Mapping-Bild (Abb. 1f–i) bestätigte weiter die gleichmäßige Verteilung der vier Elemente im Produkt MoP-NC.

a XRD-Muster für MoP. b , c REM-Aufnahmen von MoP-NC. d , e TEM- und HRTEM-Bilder von MoP-NC. f –ich entsprechende EDS-Elementarabbildungsbilder von Mo, P, C und N
Um die elementare Verteilung von MoP-NC weiter zu verstehen, wurde XPS charakterisiert. Im Mo 3d-Spektralbereich enthält Mo zwei Zustände von Mo 3+ und Mo 6+ (Abb. 2a). Das Vorhandensein von Mo 3d3/2 und Mo 3d5/2 im Mo 3+ Zustand führte zu Mikrovibrationspeaks bei 231,5 und 228,2 ev, während die Peaks von 235,5 und 232,4 ev Mo 3d3/2 . zugeschrieben wurden und Mo 3d5/2 im Mo 6+ Zustand, da die Oberfläche des MoP-NC-Materials unweigerlich an der Luft oxidiert wurde [24, 25]. In der P 2p-Region (Abb. 2b) wurden Mikrovibrationspeaks von 130,7 und 129,4 eV P 2p1/2 . zugeordnet und P 2p3/2 , die das Vorhandensein von P 3− . aufdecken [26]. Der Peak bei 133,9 eV kann auf PO4 . zurückgeführt werden 3− [27]. Im C 1s XPS-Spektrum (Abb. 2c) betrugen die den drei chemischen Bindungen entsprechenden Hauptpeaks 228,7 eV (OC=O), 284,8 eV (CN/C=C) bzw. 286,3 eV (CC) [28 ]. Das Auftreten von C-N/C=N deutet darauf hin, dass einige der Kohlenstoffatome in MoP-NC durch Stickstoffatome ersetzt wurden, um N-dotierten Kohlenstoff zu bilden. Im Spektrum von N 1s (Abb. 2d) können drei verschiedene Stickstoffumgebungen aus diesem Bereich gelöst werden, wobei die Peaks von 398,4 und 402,1 eV mit größeren Bindungsenergien den größeren Mengen an Pyridinium und den kleineren Mengen an quartärem Stickstoff entsprachen, bzw. Außerdem wurde ein Peak bei 394,5 eV als Kombination von N und Mo 3p bezeichnet [29].
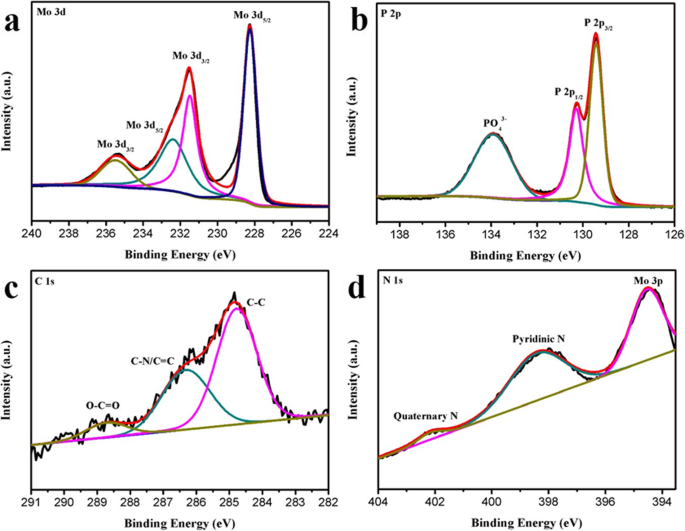
XPS-Spektren von (a) Mo 3d, (b) P 2p, (c ) C 1s und (d ) N 1s-Regionen
Die elektrokatalytische HER-Aktivität von MoP-NC in 1 M KOH (pH =14) verwendet ein typisches Drei-Elektroden-System mit einer Sweep-Geschwindigkeit von 10 mV s −1 . Da die Eigenschaften der hergestellten Materialien eine vergleichende Analyse erforderten, wurden auch Mo-NC, Bulk-MoP und MoP-C untersucht. Abbildung 3a zeigt LSV-Kurven. Die Zugabe von Pt/C und einer blanken Glaskohlenstoffelektrode (Blank) ließ die gesamten Kurven hierarchischer erscheinen. Das Überpotential von MoP-NC bei einer Stromdichte von 10 mA cm −2 benötigt nur 131 mV, was deutlich besser war als bei Mo-NC und Bulk-MoP. Darüber hinaus wurde die LSV-Leistung von MoP-C, das aus Glucose anstelle von Harnstoff als Kohlenstoffquelle hergestellt wurde, auch durch MoP-NC in den Schatten gestellt. Es ist erwähnenswert, dass im Vergleich zu HER in einer sauren Lösung die Geschwindigkeit der H-Ionen-Produktion während der Zersetzung von HER-Wasser im Alkalischen langsamer war (etwa 2–3 Größenordnungen niedriger als die saure Aktivität) und eine größere Herausforderung darstellte [30 ,31,32]. Abbildung 3b zeigt die angepasste Tafel-Graph-Gleichung:η = a + b log j , wobei b ist die Tafel-Steigung und j ist die Stromdichte [33]. Die Tafel-Steigung von Pt/C beträgt 58 mV dec −1 , verglichen mit Mo-NC (121 mV dez −1 ), Bulk-MoP (135 mV dez −1 ) und MoP-C (75 mV dez −1 ), hatte MoP-NC einen niedrigeren Parameter von nur 66 mV dec −1 , was darauf hindeutet, dass die katalytische HER-Kinetik für die MoP-NC-Elektrode schneller war. Gleichzeitig stellten wir fest, dass der MoP-NC in dieser Arbeit mit der HER-Leistung des zuvor beschriebenen Mo-basierten Komposit/Kohlenstoff-Elektrokatalysators ziemlich konkurrenzfähig war (Tabelle 1). Wie aus Tabelle 1 ersichtlich, basierten die meisten MoP-basierten Materialien auf sauren Bedingungen und wurden selten unter alkalischen Bedingungen getestet [17,18,19, 22,23,24, 34,35,36,37]. Darüber hinaus wurden einige von ihnen sowohl in saurer als auch in alkalischer Umgebung getestet [38,39,40,41]. Jedoch zeigten nur amorphe kohlenstoffbeschichtete MoP-Materialien in diesen Materialien eine bessere Leistung in alkalischen Umgebungen als in sauren Umgebungen. Der Grund, warum MoP-NC in unserer Arbeit eine gute HER-Leistung in alkalischer Umgebung erzielen kann, lag darin, dass Harnstoff im Syntheseprozess sowohl als Kohlenstoffquelle als auch als Stickstoffquelle verwendet wurde, wobei er auch etwas Gas zersetzte. Es verlangsamte die Polymerisation von N- und C-codotiertem MoP, das eine hervorragende Synthesehilfsrolle spielte. Die Stabilität der hergestellten Materialien war kontinuierlicher CV mit einer Scanrate von 100 mV s −1 . Nach 1000 Zyklen wies die LSV-Kurve einen geringen Stromdichteverlust im Vergleich zum Anfangswert auf (Abb. 3c). Abbildung 3d zeigt die CV-Plots von MoP-NC, die im gleichen Spannungsbereich (0,847–0,947 V vs. RHE) bei unterschiedlichen Abtastratenbereichen (20–200 mV) durchgeführt wurden. Um die Doppelschichtkapazität (C dl ) des Materials, das C dl einer Reihe von Kontrollgruppen wurde in Fig. 3e gezeigt. Das C dl von Mo-NC, Bulk-MoP und MoP-C betrugen 0.8 mF cm −2 , 60 μF cm −2 und 1,6 mF cm −2 , während das C dl von MoP-NC betrug 10,9 mF cm −2 die viel größer war als die oben genannten Materialien. Der Vorschlag deutete darauf hin, dass MoP-NC eine höhere aktive Oberfläche hatte. Darüber hinaus wurde die Leitfähigkeit von MoP-NC durch elektrochemische Impedanzspektroskopie (EIS) bewertet. Abbildung 3f zeigt das Nyquist-Diagramm der verschiedenen Katalysatoren. Der Ladungsübertragungswiderstand des MoP-NC-Katalysators war niedriger als der anderer Katalysatoren, was bedeutete, dass das schnellere Elektronenübertragungsverhältnis des MoP-NC-Katalysators nach der N, C-Co-Dotierung die elektrokatalytische Leistung von HER weiter verbesserte.
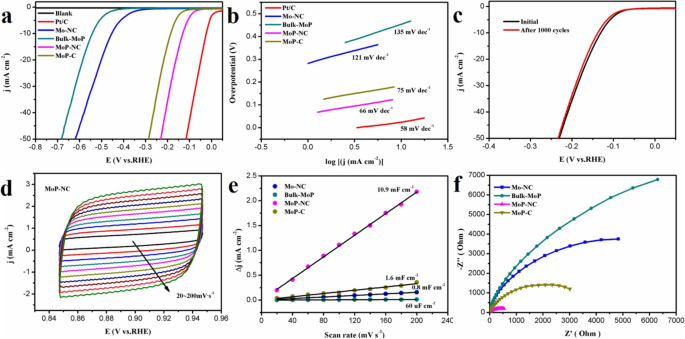
a LSV-Kurven mit einer Abtastrate von 10 mV s −1 bei Raumtemperatur in 1 &mgr;M KOH. b Tafel-Plots der so synthetisierten Proben. c Stabilität von MoP-NC nach 1000 Zyklen Voltammetrie (CV)-Zyklus. d CV-Plots von MoP-NC bei einer Abtastrate zwischen 20 und 200 mV s −1 . e Doppelschichtkondensator (C dl ) von Mo-NC, Bulk-MoP, MoP-NC und MoP-C mit einem Kondensatorstrom von 0,1 V. f Die EIS-Spektren von Mo-NC, Bulk-MoP, MoP-NC und MoP-C
Schlussfolgerungen
Zusammenfassend haben wir die amorphen kleinen Partikel von MoP-NC mit einer einfachen und effizienten zweistufigen Methode synthetisiert. Da die MoP-Nanopartikel mit Kohlenstoff beschichtet waren, aggregierten sie teilweise zusammen. Glücklicherweise beeinträchtigt diese Struktur nicht die Leistung des Materials selbst, sondern trägt auch zu seiner Stabilität bei. Dieses lokal aggregierte kleinteilige Material mit Gesamtdispersion erreichte eine Stromdichte von 10 mA cm −2 in 1 M KOH erfordert nur ein Überpotential von 131 mV, was der berichteten HER-Leistung eines einzelnen Molybdänphosphidmaterials in einer alkalischen Umgebung überlegen ist. Außerdem zeigte das Material selbst nach dem Scannen von 1000 CV-Zyklen eine vernachlässigbare Leistungsverschlechterung. Unsere Ergebnisse zeigen, dass kohlenstoffbeschichtetes MoP auch die alkalische Umgebung überwinden kann, um eine ausgezeichnete elektrokatalytische Aktivität und Stabilität von HER zu erreichen.
Verfügbarkeit von Daten und Materialien
Alle Daten sind uneingeschränkt verfügbar.
Abkürzungen
- CA:
-
Zitronensäure
- C dl :
-
Die Doppelschichtkapazität
- Lebenslauf:
-
Zyklische Voltammetrie
- EIS:
-
Elektrochemische Impedanzspektroskopie
- IHR:
-
Wasserstoffentwicklungsreaktion
- HRTEM:
-
Hochauflösende Übergangselektronenmikroskopie
- KOH:
-
Kaliumhydroxid
- LSV:
-
Lineare Sweep-Voltammetrie
- MoP:
-
Molybdänphosphid
- MoP-NC:
-
N, C codotiertes MoP
- SCE:
-
Gesättigte Kalomelelektrode
- SEM:
-
Rasterelektronenmikroskopie
- TEM:
-
Übergangselektronenmikroskopie
- TMPs:
-
Übergangsmetallphosphide
- TOP:
-
Trioctylphosphin
- XPS:
-
Röntgenphotoelektronenspektroskopie
- XRD:
-
Röntgenpulverbeugung
Nanomaterialien
- Hocheffizientes Spülmittel zum Blasformen von Polyolefinen
- MoS2 mit kontrollierter Dicke für die elektrokatalytische Wasserstoffentwicklung
- S, N codotierte Graphen-Quantenpunkt/TiO2-Komposite für eine effiziente photokatalytische Wasserstofferzeugung
- Einfache Synthese von auf MWNT verankerten SiO2@C-Nanopartikeln als Hochleistungsanodenmaterialien für Li-Ionen-Batterien
- Grüne Eintopf-Synthese von Ag-dekorierten SnO2-Mikrosphären:ein effizienter und wiederverwendbarer Katalysator für die Reduktion von 4-Nitrophenol
- Silica-Nanopartikel für die intrazelluläre Proteinzufuhr:ein neuartiger Syntheseansatz unter Verwendung von grün fluoreszierendem Protein
- Nachbehandlungsmethode zur Synthese monodisperser binärer FePt-Fe3O4-Nanopartikel
- Erforschung des Zr-Metall-organischen Gerüsts als effizienter Photokatalysator für die Wasserstoffproduktion
- Hierarchische Heterostruktur von ZnO@TiO2-Hohlkugeln für eine hocheffiziente photokatalytische Wasserstoffentwicklung
- Funktionelles poröses Polymer auf Triphenylphosphin-Basis als effizienter heterogener Katalysator für die Synthese cyclischer Carbonate aus CO2



