Ein einfacher Ansatz zur Synthese von fluoreszierenden Kohlenstoffquantenpunkten aus Tofu-Abwasser
Zusammenfassung
Wir präsentieren eine Untersuchung zu Kohlenstoffquantenpunkten (CQDs), die aus Abwasser synthetisiert werden, das bei der Herstellung von Tofu induziert wird. Wir finden, dass Tofu-Abwasser eine gute Rohstoffquelle für die Herstellung von fluoreszierenden CQDs ist. Die entsprechenden CQDs können einfach durch hydrothermale Reaktion hergestellt werden, um die organische Substanz im gelben Serofluid von Tofu-Abwasser zu karbonisieren. Zwei Arten von CQDs können in entionisiertem Wasser bzw. NaOH-Lösung erhalten werden, wobei die CQDs in Wasser (NaOH-Lösung) unter UV-Bestrahlung blaues (grünes) Licht emittieren können. Die Röntgenphotoelektronenspektroskopie (XPS) zeigt, dass der grundlegende Unterschied zwischen diesen beiden Arten von CQDs der Gehalt an C-O- und C=O-Bindungen auf der Oberfläche der CQDs ist. Dieser Unterschied kann zu unterschiedlichen Merkmalen der Photolumineszenz (PL)-Spektren der CQDs führen. Basierend auf den Ergebnissen der XPS- und PL-Messungen schlagen wir einen Mechanismus zum Verständnis und zur Erklärung der photoneninduzierten Lichtemission von CQDs vor. Diese Studie ist relevant für die Herstellung und Anwendung von fluoreszierenden CQDs, z. B. als Lichtdisplaymaterialien.
Hintergrund
Tofu, hergestellt aus Sojabohnen, ist das tägliche Essen in China und in der asiatischen Gemeinschaft. In der Vergangenheit wurden Tofu und verwandte Produkte hauptsächlich in relativ kleinen Mengen von Familien und kleinen Fabriken hergestellt. Da Vegetarier weltweit immer beliebter werden, ist die Nachfrage nach Tofu-Produkten in den letzten zwei Jahrzehnten rasant gestiegen, da die großen internationalen Supermärkte wie WalMart und Carrefour diese als Reformkost verkauft haben. Heutzutage werden Tofu und verwandte Produkte hauptsächlich von großen Fabriken im Industriepark in China in Massenproduktion hergestellt. Eines der Umweltprobleme bei der Massenproduktion von Tofu im Industriepark ist jedoch das Abwasser. Bei der Herstellung von Sojabohnenprodukten würde Abwasser mit Sojabohnengelb-Serofluid vermischt. Dieses Abwasser kann Umweltverschmutzung verursachen. Andererseits ist Tofu-Gelb-Serofluid hochkonzentriert mit organischen Stoffen und enthält Kohlenhydrate, Proteine, organische Säuren, funktionelle Oligosaccharide, wasserlöslichen Nicht-Protein-Stickstoff und Vitamine, Lipide und andere Pigmentsubstanzen. Daher ist es eine gute Rohstoffquelle für die Herstellung von Kohlenstoffquantenpunkten (CQDs) für Optik, Biomedizin und andere Anwendungen. So kann die Verwendung von Tofu-Abwasser zur Herstellung von CQDs die Abfälle aus der Massenproduktion von Tofu wiederverwenden und die Umweltverschmutzung weitgehend reduzieren. Diese werden zur Hauptmotivation unserer vorliegenden Studie.
Kohlenstoffquantenpunkte sind eine neue Klasse von kohlenstoffbasierten Nanomaterialien, die normalerweise eine räumliche Größe von 20 nm oder weniger aufweisen [1, 2]. Es wurde festgestellt, dass die CQDs eine gute Wasserlöslichkeit, hohe chemische Inertheit, geringe Toxizität und ausgezeichnete Biokompatibilität aufweisen [3, 4]. Aus physikalischer Sicht ähnelt das elektronische Energiespektrum eines CQD einem Halbleiter mit direkter Bandlücke. Daher wurden die CQDs als fluoreszierende Materialien für fortschrittliche optische und optoelektronische Bauelemente vorgeschlagen [5, 6]. In den letzten Jahren wurden die CQDs ziemlich intensiv untersucht. Zur Realisierung der CQDs für optische Anwendungen wurden verschiedene Herstellungsverfahren und verschiedene Rohstoffquellen verwendet [5,6,7]. Im Allgemeinen kann die Synthese von CQDs durch Top-Down- und Bottom-Up-Ansätze erreicht werden [8]. Die Top-Down-Methode ist hauptsächlich ein physikalischer Ansatz zur Bildung von Kohlenstoffpunkten durch Brechen oder Abschälen größerer Kohlenstoffmaterialstrukturen, einschließlich Bogenentladung [9], elektrochemische Oxidation [10], chemische Oxidation [11], Laserablation [12] usw. Die Bottom-up-Methode besteht darin, die kleinen Moleküle als Vorstufen zu verwenden, um CQDs durch chemische Reaktionen zu erhalten, einschließlich Verbrennung [13], Mikrowellen [14] und Ultraschallansätzen [15] zusammen mit chemischer Lösungssynthese [16], hydrothermale Reaktion [17 ] usw.
In den letzten Jahren wurde Biomasse wie Weizenstroh [18] und Pflanzenblätter [19] häufig als Kohlenstoffquelle für die Synthese der CQDs verwendet. Darüber hinaus wurden wasserlösliche fluoreszierende CQDs durch hydrothermale Behandlungen von Orangensaft [20] und Jinhua-Bergamotte [21] hergestellt, die als Kohlenstoffquellen verwendet werden. Ein so einfacher Ansatz wurde für die großtechnische Synthese wasserlöslicher CQDs aus vielen Arten von aus Lebensmittelabfällen gewonnenen Quellen angewendet [22].
In dieser Studie verwenden wir gelbes Tofu-Serofluid als Kohlenstoffquelle, um die CQDs zu synthetisieren, indem wir die hydrothermale Methode verwenden, um die organischen Stoffe im gelben Serofluid zu karbonisieren. Es wurde darauf hingewiesen [17], dass die hydrothermale Methode ein einfacher und kostengünstiger Ansatz ist, der auf die großmaßstäbliche und einstufige Synthese wasserlöslicher fluoreszierender CQDs angewendet werden kann. Für die optische Anwendung der CQDs, insbesondere als Lichtanzeigematerialien, ist es wünschenswert, fluoreszierende CQDs herstellen zu können, die blaue, grüne und rote Strahlung emittieren können. In diese Richtung gehen unsere aktuellen Forschungsarbeiten. In der vorliegenden Studie bereiten wir eine Reihe von fluoreszierenden CQDs zur Untersuchung vor. Zur Charakterisierung der hergestellten CQDs werden die Transmissionselektronenmikroskopie und die Röntgenphotoelektronenspektroskopie eingesetzt. Das Photolumineszenz-Experiment wird verwendet, um die optischen Eigenschaften der CQDs zu messen.
Methoden
In dieser Studie wird das Abwasser der Tofu-Produktion aus dem Tofu-Industriepark im Kreis Shi Ping, Yunnan, China, entnommen. Die allgemeinen Verfahren zur Synthese der CQDs aus gelbem Serofluid in Tofu-Abwasser können wie folgt beschrieben werden:(i) Wir stellen die Kohlenstoffvorläufermaterialien durch Pyrolyse des gelben Tofu-Zellstoffs in Abwasser her. Hier werden 300 ml Tofu-Gelbsirup in den 500-ml-Becher gegeben und zum konstanten Erhitzen auf die Heizplattform gestellt. Wir stellen fest, dass bei einer Heiztemperatur von etwa 93 °C und einer Heizzeit von 3 bis 5 h das tofugelbe Serofluid im Becherglas trocken werden kann. (ii) Wir lassen das Material im Becherglas auf natürliche Weise auf Raumtemperatur abkühlen und geben 50–200 ml entionisiertes Wasser in das Becherglas. (iii) Die Mischung wird 4 Minuten lang magnetisch gerührt, um eine gleichmäßige und vollständige Mischung der Stoffe und des Wassers zu erreichen. (iv) Die Mischung wird 5 Minuten lang einem Ultraschallschock ausgesetzt, um die sich verlierenden Cluster aufzubrechen. Auf diese Weise können wir den Überstand erhalten, der Kohlenstoffpunkte enthält. (v) Der Überstand wird bei einer Geschwindigkeit von 12.000 U/min für 20 Minuten weiter zentrifugiert, und der weitere Überstand kann erhalten werden. Als Ergebnis können die CQDs schließlich in entionisiertem Wasser gewonnen werden. Es wurde festgestellt, dass die Erhitzungstemperatur, die Erhitzungszeit und der pH-Wert des gelben Zellstoffwassers im Syntheseprozess das Wachstum der CQDs ziemlich stark beeinflussen können. Daher können die CQDs mit bestimmten Fluoreszenzmerkmalen durch Variieren der obigen Synthesebedingungen hergestellt werden. Wir bemerken bei der Beobachtung mit bloßem Auge bei Tageslicht, dass der Überstand mit CQDs, die unter den oben genannten experimentellen Bedingungen hergestellt wurden, gelb aussieht. Es kann jedoch unter der UV-Bestrahlung blau aussehen. Wir nennen diese Art von fluoreszierenden CQDs in diesem Artikel als CQDs-1.
Durch einen ähnlichen Syntheseansatz können wir die CQDs herstellen, indem wir NaOH als Lösung zum Verbrennen von trockenem gelbem Tofu-Serofluid nach der Pyrolyse verwenden, anstatt wie oben beschrieben entionisiertes Wasser zu verwenden. Wir geben 100 ml NaOH-Lösung mit einem pH-Wert von etwa 12,4 hinzu. Nach den gleichen Verfahren des Magnetrührens, Ultraschallschocks und Zentrifugierens wie oben beschrieben können wir die CQDs auch in der NaOH-Lösung gewinnen. Diese CQDs sehen auch bei Tageslicht mit bloßem Auge gelb aus. Sie können jedoch unter der UV-Bestrahlung grün aussehen. Wir nennen diese Art von fluoreszierenden CQDs in diesem Artikel als CQDs-2.
In dieser Arbeit haben wir zwei Arten von CQDs hergestellt, die unter UV-Bestrahlung grünes und blaues Licht emittieren können. Die weitere Untersuchung der vorliegenden Arbeit wird hauptsächlich für diese beiden Arten von CQDs durchgeführt, die aus Tofu-Abwasser hergestellt werden.
Ergebnisse und Diskussionen
Zur Charakterisierung der aus Tofu-Abwasser synthetisierten CQDs führen wir zunächst die morphologische Analyse dieser CQDs durch. In Abb. 1 zeigen wir das typische Bild der CQDs in deionisiertem Wasser und NaOH-Lösung (CQDs-1 und CQDs-2), das mit hochauflösender Transmissionselektronenmikroskopie (TEM) gewonnen wurde. Wie wir sehen können, sind die hergestellten CQDs kugelförmig und in entionisiertem Wasser (für CQDs-1) oder NaOH-Lösung (für CQDs-2) monodispers. Durch einen statistischen Durchschnitt des TEM-Bildes liegt die Partikelgröße dieser CQDs im Bereich von 2 bis 10 nm. Wir stellen fest, dass diese CQDs stark kristallisiert sind und die typische Gitterstruktur von Kohlenstoff aufweisen. Die Gittersäume sind klar und der entsprechende Gitterabstand beträgt etwa 0,22 bzw. 0,21 nm. Wir möchten darauf hinweisen, dass die in Abb. 1 gezeigten Ergebnisse denen sehr ähnlich sind, die zuvor für den N- und S-Dotierungsgehalt in N- und S-CQDs mit hoher Ausbeute berichtet wurden [23, 24]. Darüber hinaus stellen wir fest, dass die Größenverteilung der CQDs in entionisiertem Wasser (CQDs-1) oder in NaOH-Lösung (CQDs-2) hauptsächlich bei 3,5–5,5 nm liegt und die Dicke dieser CQDs etwa 3,5 nm beträgt.

a TEM-Bilder für CQDs in deionisiertem Wasser (CQDs-1) und b TEM-Bilder für CQDs in NaOH-Lösung (CQDs-2). c , d Vergrößertes Bild eines einzelnen CQD von a und b , bzw.
Wie wir wissen, ist die Röntgen-Photoelektronenspektroskopie (XPS) ein leistungsstarkes Werkzeug zur Messung und zum Verständnis der elementaren Zusammensetzungen und des Inhalts der CQDs, insbesondere zur Untersuchung oberflächenmodifizierter Merkmale der CQDs wie der funktionellen Gruppen auf der Oberfläche der CQDs [25]. In Abb. 2 sind die XPS-Vollspektren für CQDs-1 und CQDs-2 dargestellt und die entsprechenden Ergebnisse angegeben. Wir bemerken, dass die hier gemessenen CQDs hauptsächlich C (mit einer typischen Bindungsenergie C ls = 284.8 eV), N (mit einer typischen Bindungsenergie N ls = 400 eV) und O (mit einer typischen Bindungsenergie O ls = 532 eV .) enthalten ). Die anderen Elemente wie S und P (Na und Cl) finden sich auch in CQDs-1 (CQDs-2). Als Ergebnis sehen wir, dass CQDs-1 hauptsächlich aus C-, N-, O-, S- und P-Elementen besteht, wobei das Atomverhältnis dieser Elemente C1s:O1s:N1s:S2p:P2p = 61.0:29.6:8.5 . ist :0.5:0.4. Wir sehen auch, dass CQDs-2 hauptsächlich aus C-, O-, N-, Na- und Cl-Elementen besteht. Das Atomverhältnis dieser Elemente beträgt C1s:O1s:N1s:Na1s:Cl2p = 66,7:26,2:6,8:0,1:0,1. Da das Tofu-Abwasser selbst Chlorid und Sulfat enthält, die durch den Herstellungsprozess von Tofu induziert werden, gibt es in Abb. 2 ziemlich breite Spektren von S- und Cl-Signalen. Da CQDs-2 außerdem für CQDs in NaOH-Lösung bestimmt ist, in der NaOH eine Rolle spielen kann Rolle als Passivierung der CQDs, gibt es ein Na-Signal im unteren Feld von Abb. 2.
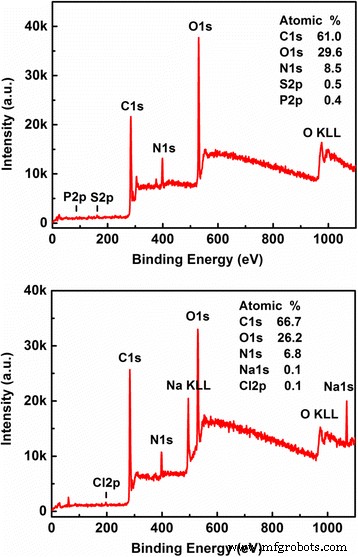
Das XPS-Vollspektrum für CQDs-1 (oberes Feld) bzw. CQDs-2 (unteres Feld), wobei der erhaltene Inhalt der Elemente angegeben ist
In Abb. 3 zeigen wir die hochauflösenden C1s-Spektren für CQDs-1 bzw. CQDs-2, angepasst an eine Bindungsenergie Cls. Aus dem C1s-Spektrum im oberen Feld von Abb. 3 ist ersichtlich, dass in CQDs-1 . drei chemische Bindungen C–C/C=C bei 284,7 eV, C–O bei 286,08 eV und C=O bei 287,86 eV vorhanden sind . In CQDs-2 sind vier chemische Bindungen C–C bei 284,8 eV, C–O bei 286,16 eV, C=O bei 288 eV und COOH bei 289,14 eV vorhanden, wie im unteren Feld von Abb. 3 gezeigt Die in Abb. 3 gezeigten XPS-Ergebnisse zeigen, dass der grundlegende Unterschied zwischen CQDs-1 und CQDs-2 der Gehalt an C-O- und C=O-Bindungen auf der Oberfläche der CQDs in Wasser bzw. NaOH-Lösung ist. Es ist bekannt, dass die OH − in NaOH-Lösung kann mit C–O- und C=O-Bindungen auf der Oberfläche der CQDs zu COOH und der Carboxylgruppe koppeln und somit den Gehalt an C–O- und C=O-Gruppen in CQDs-2 reduzieren. Dies ist der Hauptgrund, warum der Gehalt an C-O- und C=O-Bindungen in CQDs-1 deutlich höher ist als in CQDs-2.
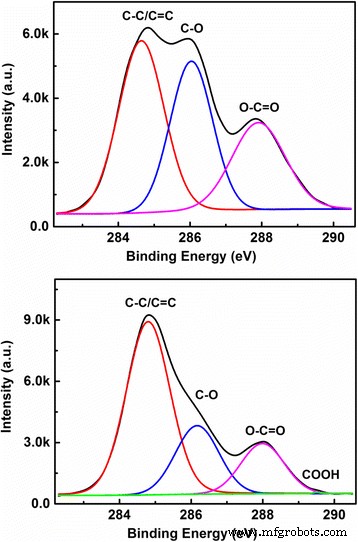
Das hochauflösende C1s-Spektrum für CQDs-1 (oberes Feld) bzw. CQDs-2 (unteres Feld), angepasst durch eine Bindungsenergie C1s
In dieser Studie verwenden wir einen standardmäßigen experimentellen Aufbau, um die Photolumineszenz (PL)-Emission von CQDs zu messen, die aus Tofu-Abwasser in sichtbarer Bandbreite realisiert werden. Für die Messung wird das HORIBA Fluoreszenzsystem (USA) verwendet, wobei eine Xenonlampe als breitbandige Anregungslichtquelle verwendet wird, der GEMIMI 180 Monochromator zur Wahl der optischen Pumpwellenlänge verwendet wird und das iHR320 Gitterspektrometer zusammen mit einem photoelektrischen Multiplikator Tube (PMT)-Detektor wird zur Aufnahme des Spektrums der Lichtemission von Proben verwendet. Die Messungen werden bei Raumtemperatur durchgeführt. In Abb. 4 zeigen wir die PL-Emissionsspektren für CQDs-1 im oberen Feld und CQDs-2 im unteren Feld bei verschiedenen Anregungswellenlängen λ ex . Bei der PL-Messung beginnt die Aufzeichnung der Intensität des Emissionslichts oft nach der Anregungswellenlänge, um eine Beschädigung des PMT-Detektors auszuschließen. Daher gab es Cutoffs in den Kurven der PL-Spektren in Abb. 4. Wir bemerken die folgenden Merkmale:(i) Die Intensität der PL-Emission nimmt mit zunehmender Anregungswellenlänge zuerst zu und dann ab. Die stärkste PL-Emission kann bei etwa λ . beobachtet werden ex ~ 410 nm für CQDs-1 bzw. 480 nm für CQDs-2. (ii) Die Spitzenwellenlängenposition λ em im PL-Spektrum variiert mit der Änderung der Anregungswellenlänge sowohl für CQDs-1 als auch für CQDs-2. In den Einfügungen von Abb. 4 zeigen wir λ em als Funktion von λ ex so können wir deutlicher sehen, wie sich die PL-Peaks mit der Anregungswellenlänge verschieben. Wie in Abb. 4 gezeigt, λ em steigt monoton mit λ . an ex sowohl für CQDs-1 als auch für CQDs-2. (iii) Im relativ kürzeren Anregungswellenlängenbereich sind für CQDs-1 zwei PL-Peaks zu beobachten, während für CQDs-2 im Wellenlängenbereich von 420–510 nm nur ein PL-Peak zu sehen ist. (iv) CQDs-1 kann zu einem breiteren PL-Spektrum führen als CQDs-2. (v) Die durch CQDs-1 induzierte PL-Peakwellenlänge ist kürzer als die durch CQDs-2 induzierte. Bei einer Anregungswellenlänge von 410 nm kann die blaue Fluoreszenz durch CQDs-1 erreicht werden, während bei einer Anregungswellenlänge von 480 nm die grüne Fluoreszenz für CQDs-2 zu sehen ist. (vi) Die Fluoreszenz der CQDs-1 mit 8,5% N-Dotierungsgehalt ist höher als die der CQDs-2 mit 6,8% N-Dotierungsgehalt. Der Grund, warum die PL-Emission mit dem N-Dotierungsgehalt von CQDs zunimmt, liegt darin, dass die N-Dotierung eine neue Art von Oberflächenzustand einführen kann. Durch die neu gebildeten Oberflächenzustände eingefangene Elektronen können eine hohe Ausbeute an Strahlungsrekombination ermöglichen [24]. Die aus dieser Studie erhaltenen PL-Ergebnisse zeigen, dass die blaue und grüne Lichtemission durch CQDs-1 bzw. CQDs-2 unter optischem Pumpen erreicht werden kann.
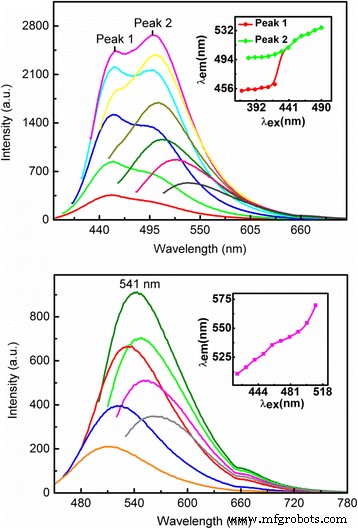
Das PL-Spektrum für CQDs-1 im oberen Feld und CQDs-2 im unteren Feld bei verschiedenen Anregungswellenlängen λ ex . Im oberen Bereich λ ex sind 370 nm (rot), 380 nm (grün), 390 nm (blau), 400 nm (hellblau), 410 nm (tiefrosa), 420 nm (gelb), 430 nm (hellgrün), 440 nm (dunkel .) grün), 450 nm (hellrot) und 490 nm (dunkles Olivgrün). Im unteren Bereich λ ex sind 420 nm (orange), 440 nm (blau), 460 nm (gelb), 480 nm (rot), 490 nm (grün), 500 nm (pink) und 510 nm (dunkles Olivgrün). Die Einschübe zeigen die Peakwellenlänge im PL-Spektrum, λ em, als Funktion der Anregungswellenlänge
Derzeit ist der physikalische Mechanismus der Photonen-induzierten Lichtemission von CQDs noch unklar. Die Ergebnisse verwandter Untersuchungen [12, 26, 27] haben jedoch gezeigt, dass die Oberflächenmodifizierung der CQDs durch funktionelle Amino- und Carboxylgruppen eine wichtige Rolle für die PL-Emission von CQDs spielen kann. Die Eigenschaften des PL-Spektrums von CQDs werden nicht nur durch die Partikelgröße der CQDs [1], sondern auch durch die Oberflächeneigenschaften der CQDs [26, 27] bestimmt. Basierend auf unseren XPS- und PL-Ergebnissen aus der vorliegenden Studie diskutieren wir nun den physikalischen Mechanismus hinter den in Abb. 4 gezeigten experimentellen Ergebnissen für CQDs aus Tofu-Abwasser. Wir wissen, dass die elektronische Bandstruktur von CQDs der eines Halbleiters mit direkter Bandlücke sehr ähnlich ist. Für CQDs, die aus Tofu-Abwasser in verschiedenen Lösungen wie Wasser und NaOH synthetisiert wurden, befinden sich jedoch C–O-, C = O- und COOH-Bindungsbasierte funktionelle Gruppen auf der Oberfläche der CQDs, wie die XPS-Ergebnisse in Abb. 3. Die Energiezustände dieser funktionellen Gruppen sind Oberflächenzustände, die zwischen dem Leitungs- und Valenzband der CQDs liegen. Sie spielen eine Rolle wie Zwischenzustände, die den Störstellenzuständen in einem Halbleiter mit direkter Bandlücke sehr ähnlich sind. Bei Vorhandensein eines Anregungslichtfeldes werden die Elektronen im Valenzband der CQDs über einen optischen Absorptionsmechanismus in das Leitungsband gepumpt. Da die Position des PL-Peaks im Spektrum von der Anregungswellenlänge abhängt, ist die PL-Emission über den exzitonischen Mechanismus [28] bei diesen CQDs nicht der Fall. Die photoneninduzierte Lichtemission von CQDs ist daher eine Folge der direkten Photoemission, die durch elektronische Übergänge von höheren Energieniveaus zu niedrigeren Energiezuständen induziert wird. Wie wir wissen, befinden sich die Elektronen normalerweise mit einer schnelleren oder kleineren Relaxationszeit in den höheren Energiezuständen als in den niedrigeren Energiezuständen. Die Ergebnisse unserer XPS- und PL-Messungen legen nahe, dass der strahlende elektronische Übergang in CQDs hauptsächlich über die Relaxation von Elektronen aus den Oberflächenzuständen in das Valenzband der CQDs erreicht wird. Die erhaltenen experimentellen Ergebnisse zeigen, dass die Intensität der PL-Emission von CQDs, die mit KOH hergestellt wurden, viel stärker ist als die von NaOH. Bei gleicher Anregungswellenlänge stellen wir fest, dass die Alkaliionen in alkalischen Lösungen die Position der PL-Emissionswellenlänge nicht wesentlich beeinflussen.
Für den Fall, dass sich die CQDs in Wasser befinden (CDQs-1), gibt es zwei Zwischenzustände, die durch Oberflächenzustände der C–O- und C=O-Bindungen und verwandter funktioneller Gruppen induziert werden. Diese beiden Oberflächenzustände haben unterschiedliche Energieniveaus und entsprechende Auswahlregeln für strahlende elektronische Übergänge, die für die Emission von PL mit zwei Emissionswellenlängen bei relativ kurzwelliger Lichtanregung verantwortlich sind. Die photoangeregten Elektronen in den höheren Energiezuständen im Leitungsband von CQDs relaxieren zunächst über nichtstrahlende Relaxationsmechanismen wie Elektron-Phonon-Streuung und Elektron-Elektron-Wechselwirkung schnell in die Oberflächenzustände. Wenn die strahlungsfreie elektronische Relaxationszeit für Elektronen in den Oberflächenzuständen länger oder größer als die strahlende elektronische Relaxationszeit ist, können diese Elektronen in das Valenzband zurückkehren und Photonen emittieren. Mit abnehmender Pumpwellenlänge können mehr Zustände im Valenzband und insbesondere im Leitungsband an diesem Pump-, Relaxations- und Lichtemissionsprozess teilnehmen und somit nimmt die Peakwellenlänge im Lichtemissionsspektrum mit der Anregungswellenlänge ab. Daher hängt die Wellenlänge der Lichtemission von der Wellenlänge des Anregungslichts ab. Die Zunahme der Spitzenwellenlänge der Lichtemission mit der Anregungswellenlänge impliziert, dass die nichtstrahlende elektronische Relaxationszeit mit sinkenden Energieniveaus in den Oberflächenzuständen zunimmt. Bei relativ langwelliger Lichtanregung werden die photoangeregten Elektronen in CQDs schnell vom Leitungsband auf die niedrigeren Energieniveaus der Oberflächenzustände entspannt und emittieren Photonen. Die Möglichkeit der Emission von Photonen aus höheren Energieniveaus der Oberflächenzustände wird so gering, dass der Effekt nicht deutlich gemessen werden kann.
Für den Fall, dass die CQDs in NaOH-Lösung (CDQs-2) vorliegen, gibt es nur einen Zwischenzustand für die strahlenden elektronischen Übergänge. Da der Gehalt an C–O- und C=O-Bindungen und verwandten funktionellen Gruppen in diesem Fall relativ gering ist, handelt es sich bei den strahlenden Oberflächenzuständen hauptsächlich um induzierte COOH-basierte Gruppen für CQDs-2. Als Ergebnis kann nur ein Peak der PL-Emission beobachtet werden. Da die Energieniveaus der durch C–O- und C=O-Bindungen und verwandter funktioneller Gruppen induzierten Oberflächenzustände normalerweise höher sind als die durch COOH-Gruppen induzierten, kann für CQDs-1 die kürzerwellige PL-Emission beobachtet werden. Dies ist der Hauptgrund, warum CQDs-1 blaues Licht emittieren können, während CQDs-2 bei optischer Anregung grünes Licht emittieren können.
Die Quanteneffizienz Q der Fluoreszenz für CQDs-1 kann aus den experimentellen Daten ausgewertet werden über [29, 30]
$$ Q={Q}_{\text{s}}\times \frac{I_{\textrm{s}}}{I}\times \frac{A}{A_{\textrm{s}}}\ mal \frac{\eta^2}{{\eta_{\mathrm{s}}}^2} $$ (1)Hier Q s ist die Quanteneffizienz der Fluoreszenz für eine Standardprobe als Referenz. Bei einer festen Anregungswellenlänge von z. B. 364 nm I und ich s sind die integrierten Emissionsintensitäten der CQDs-1-Probe bzw. der Standardprobe. A und A s sind jeweils die Extinktion der präparierten Probe und der Standardprobe bei derselben Anregungswellenlänge. η und η s sind jeweils das Brechungsvermögen der präparierten Probe und der Standardprobe. Es wurde festgestellt, dass die Fluoreszenzquanteneffizienz von CQDs-1 etwa 54,49 % beträgt. Da wir die Referenzprobe für CQDs-2 nicht finden können, wird die Fluoreszenzquanteneffizienz von CQDs-2 in der vorliegenden Studie nicht bewertet.
Schlussfolgerungen
In dieser Studie haben wir die Kohlenstoffquantenpunkte (CQDs) aus Abwasser hergestellt, das bei der Herstellung von Tofu induziert wird. Wir haben gezeigt, dass das Tofu-Abwasser eine gute Rohstoffquelle für die Herstellung von CQDs ist. Die fluoreszierenden CQDs können einfach durch hydrothermale Reaktion hergestellt werden, um die organischen Stoffe im gelben Serofluid von Tofu-Abwasser zu karbonisieren. Die durchschnittliche Größe der aus Tofu-Abwasser synthetisierten CQDs kann bis zu 3,5 nm betragen. Wir haben zwei Arten von CQDs in entionisiertem Wasser bzw. in NaOH-Lösung erhalten. Sie können unter UV-Bestrahlung blaues bzw. grünes Licht emittieren. Die Röntgenphotoelektronenspektroskopie (XPS) zeigt, dass der grundlegende Unterschied zwischen diesen beiden Arten von CQDs der Gehalt an C-O- und C=O-Bindungen auf der Oberfläche der CQDs ist. Dieser Unterschied kann unterschiedliche Eigenschaften des Photolumineszenz(PL)-Spektrums der CQDs verursachen. Auf der Grundlage der erhaltenen Ergebnisse aus den XPS- und PL-Messungen haben wir einen Mechanismus zum Verständnis und zur Erklärung der photoneninduzierten Lichtemission von CQDs vorgeschlagen. Eine der wichtigsten Schlussfolgerungen aus dieser Studie ist, dass die Verwendung von Tofu-Abwasser zur Synthese der CQDs nicht nur hilfreich sein kann, um das durch das Abwasser verursachte Umweltproblem zu lösen, sondern auch eine einfache und kostengünstige Massenproduktion von CQDs für Bio- und optische Anwendungen. Die blau und grün fluoreszierenden CQDs haben wir bisher erfolgreich aus Tofu-Abwasser gewonnen. Die Herausforderung unserer aktuellen Arbeit besteht darin, CQDs zu erhalten, die unter optischem Pumpen rotes Licht emittieren können.
Nanomaterialien
- N,N-Dimethylformamid, das die Fluoreszenz von MXen-Quantenpunkten für die empfindliche Bestimmung von Fe3+ reguliert
- Aktivkohlefasern mit hierarchischer Nanostruktur aus Baumwollhandschuhabfällen als Hochleistungselektroden für Superkondensatoren
- Synthese von Pyridin-reichen N,S-codotierten Kohlenstoff-Quantenpunkten als wirksame Enzymnachahmer
- Silica-Nanopartikel für die intrazelluläre Proteinzufuhr:ein neuartiger Syntheseansatz unter Verwendung von grün fluoreszierendem Protein
- Grüne Synthese von InP/ZnS-Kern/Schale-Quantenpunkten für die Anwendung in schwermetallfreien Leuchtdioden
- Magnetische Kohlenstoff-Mikrosphären als wiederverwendbares Adsorptionsmittel zur Entfernung von Sulfonamid aus Wasser
- Eliminierung der bimodalen Größe in InAs/GaAs-Quantenpunkten zur Herstellung von 1,3-μm-Quantenpunktlasern
- Material und optische Eigenschaften von fluoreszierenden Kohlenstoff-Quantenpunkten, die durch hydrothermale Reaktion aus Zitronensaft hergestellt werden
- Design von Strain-Engineered GeSn/GeSiSn-Quantenpunkten für direkte Bandlückenemission im mittleren IR-Bereich auf Si-Substrat
- Einfache Eintopf-Synthese von Polydopamin-Kohlenstoffpunkten für die photothermische Therapie



