Die kostengünstige Herstellung grüner fluoreszierender Kohlenstoffpunkte für die Biobildgebung und die verbesserte intrazelluläre Wirkstoffabgabe
Zusammenfassung
Doxorubicin-eingeschlossene Kohlenstoffpunkte (DOX-CDs) wurden für Bioimaging und verbesserte intrazelluläre Arzneimittelabgabe hergestellt. Die CDs wurden über die hydrothermale Methode unter Verwendung von Citrat und Harnstoff bei 200 °C für 1 h synthetisiert. Anschließend wurde DOX über physikalisch-chemische Wechselwirkungen erfolgreich an die CDs konjugiert. Die DOX-CDs zeigten eine gute Kristallstruktur, bemerkenswerte Wasserstabilität, ausgezeichnete Photolumineszenzeigenschaften und eine hohe Quantenausbeute von 93%. Die Fluoreszenzbilder zeigten, dass die DOX-CDs leicht von den Krebszellen zur Zellmarkierung aufgenommen werden konnten. Darüber hinaus wurde ein endo-lysosomales pH-unterstütztes DOX-Freisetzungsverhalten von DOX-CDs beobachtet und die Zytotoxizität von DOX-CDs wurde durch den MTS-Assay gegen H0-8910 Eierstockkrebszellen bestätigt. Darüber hinaus zeigten die CDs im Tier-Imaging-Test ein helles Fluoreszenzsignal und zeigten nach Verabreichung über 7 und 21 Tage eine geringe Toxizität. Daher könnten die hergestellten CDs eine vielversprechende Bildgebungssonde für die biomedizinische Bildgebung und die intrazelluläre Wirkstoffabgabe sein.
Einführung
Doxorubicin (DOX) ist ein Anthrazyklin-Chemotherapeutikum, das häufig zur Behandlung verschiedener Krebsarten eingesetzt wird, darunter Brust-, Lungen-, Magen-, Eierstock-, Schilddrüsen-, multiples Myelom, Sarkom und pädiatrische Krebsarten. Der Mechanismus der Anti-Krebs-Wirkung von DOX wird als Störung der DNA-Synthese und des Reparaturprozesses angesehen. Daher muss DOX durch die Zellmembran und zum Zellkern transportiert werden, um die DNA-Synthese während der Krebsbehandlung zu stören. Freies DOX könnte sich jedoch dem Zellkern nicht leicht nähern und würde eine schwere in-vivo-Kardiotoxizität induzieren, die seine Anwendung als Krebstherapie behindert [1, 2].
In letzter Zeit haben multifunktionale Nanoträger wie Liposomen, Micellen, Nanoemulsionen, polymere Nanopartikel und andere Nanopartikel aufgrund ihrer Bedeutung für die Wirkstoffabgabe gegen Krebs enorme Aufmerksamkeit auf sich gezogen [3]. Unter ihnen hat der Kohlenstoffquantenpunkt (CD) als neuer Typ der Quantenpunktfamilie seit seiner Entdeckung im Jahr 2004 weltweit enormes Interesse auf sich gezogen [4]. Insbesondere fluoreszierende CDs werden bei der Zellbildgebung bevorzugt 2 , Photokatalyse, Wirkstoffabgabe, Schadstoff- und Schwermetallionendetektion und photoelektrische Geräte aufgrund ihrer überlegenen Eigenschaften in Bezug auf Gewicht und Größe von quasi Null (<10 nm), hohe Photostabilität, breite und kontinuierliche Anregungsspektren, abstimmbare Wellenlänge, zufriedenstellende Biokompatibilität , geringe Toxizität und ausgezeichnete Leistung bei der Fluoreszenz [5,6,7,8,9,10,11,12,13,14]. Yang et al. haben DOX erfolgreich an die CDs für eine verbesserte Krebsbehandlung gekoppelt, was darauf hindeutet, dass CDs eine große Bedeutung für die nukleusgerichtete Wirkstoffabgabe haben [1].
Zuvor wurden verschiedene Techniken zur Herstellung von CDs vorgeschlagen, darunter zahlreiche Biomassematerialien, Carbonisierung, Passivierung und Oberflächenfunktionalisierung [14, 15]. Im Detail kann es in zwei Hauptmethoden eingeteilt werden. Einer davon ist der „Top-Down“-Ansatz, die Bogenentladung, das Laserablationsverfahren, das elektrochemische Ätzen und das Oxidationsverfahren, das sich auf das Aufbrechen der großflächigen Kohlenstoffstruktur in Kohlenstoffnanopartikel bezieht [16,17,18,19,20]. Die andere Methode ist die „bottom-up“-Methode, die Kohlenstoffpunkte aus molekularen Vorläufern synthetisiert, hauptsächlich einschließlich hydrothermaler Ansätze, Ultraschallverfahren und wellenunterstützter Synthese [21,22,23,24]. Xuet al. Kohlenstoffpunkte durch Bogenentladung, Oxidation, Extraktion und Gelelektrophorese erhalten. Minget al. durch Elektrolyse gewonnene Kohlenstoffpunkte. Yanget al. optimierten die ursprüngliche hydrothermale Methode, um Kohlenstoffpunkte mit unterschiedlicher Fluoreszenz zu synthetisieren [21]. Diese Methoden sind jedoch aufgrund ihres komplizierten Syntheseprozesses, der zeitaufwendigen Vorgehensweise, der strengen Herstellungsanforderungen und der teuren Rohstoffe eingeschränkt [25]. Darüber hinaus kann die Verwendung organischer Lösungsmittel als Passivierungsmittel für die Reaktion die Toxizität von CDs erhöhen [26]. Außerdem emittierten die meisten der beschriebenen CDs unter UV-Licht-Anregung blaue Fluoreszenz, was ihr Potenzial im Bereich der biomedizinischen Bildgebung ernsthaft behinderte, was auf die starke Gewebeautofluoreszenz-Interferenz zurückzuführen ist.
Hier synthetisierten wir grün fluoreszierende CDs über eine grüne und effiziente einstufige kontrollierte thermische Pyrolyse von Natriumcitrat-Dihydrat und Harnstoff. DOX wurde nicht-kovalent an die Oberfläche präparierter CDs für die Wirkstoffabgabe mittels hydrophober und elektrostatischer Wechselwirkung sowie π . konjugiert -π Stapelwechselwirkung [27,28,29]. Die Morphologie und Struktur von CDs wurden durch Transmissionselektronenmikroskopie (TEM) und Röntgenbeugungsanalyse untersucht. Die optischen Eigenschaften wurden durch UV-Vis-Spektrometer und Photolumineszenz(PL)-Emissionsspektren bewertet. Die verzögerte Wirkstofffreisetzung wurde durch das Dialyseverfahren durchgeführt. Die zelluläre Aufnahme und die intrazelluläre Verteilung von DOX-CDs wurden fluoreszenzmikroskopisch untersucht. Die Antikrebswirkung von DOX-CDs wurde durch einen Standard-MTS-Assay bestimmt. Die in-vivo-Bildgebung von CDs wurde an Balb/c-Nacktmäusen durchgeführt. Schließlich wurde die Langzeittoxizität von CDs durch die histologische Analyse untersucht. Daher wären die präparierten CDs ein potenzieller Wirkstoff für die In-vivo-Bildgebung und die gezielte Wirkstoffabgabe.
Materialien und Methoden
Materialien
Natriumcitratdihydrat, Harnstoff, L-Arginin, Ethylendiaminaceton, Chininsulfat, phosphatgepufferte Kochsalzlösung (PBS), Essigsäure, Dinatriumhydrogenphosphat und Paraformaldehyd wurden von Sinopharm Chemical Reagent Co. Ltd (Shanghai, China) bezogen. MTS Cell Proliferation Colorimetric Assay Kit (MTS), Dulbecco's Modified Eagle Medium (DMEM/high Glucose), Penicillin-Streptomycin-Lösung und Trypsin-EDTA-Lösung wurden von Beyotime Biotechnology Co. Ltd (Shanghai, China) bezogen. Fötales Rinderserum (FBS) wurde von Tianhang Biotechnology Co. Ltd (Hangzhou, China) bezogen. Die Eierstockkrebszellen HO-8910 und die Endothelzellen der menschlichen Nabelvene EA.hy926 wurden vom Shanghai Institute of Nutrition and Health, Chinese Academy of Sciences (Shanghai, China) erhalten. Doxorubicinhydrochlorid (DOX) wurde von Sigma-Aldrich (Shanghai, China) bezogen. Die Dialysebeutel (MWCO =1000 Da) wurden von SpectrumLabs (Los Angeles, CA, USA) bezogen.
Synthese von CDs und DOX-CDs
Kurz gesagt wurden Natriumcitrat-Dehydrat (0,2 mmol) und Harnstoff (5 mmol) zuerst in 1 &mgr;l entionisiertem Wasser gelöst. Dann wurde die Mischung in ein Glasgefäß überführt und 1 h bei 200 °C carbonisiert. Danach wurden 1 ml entionisiertes Wasser und Aceton (Vol./Vol., 1/3) zugegeben und dreimal bei 10000 U/min für 10 Minuten zentrifugiert
DOX wurde auf den CDs durch die nichtkovalente Wechselwirkung konjugiert. Kurz gesagt, DOX·HCl (0,5 mg) wurde zu 5 ml CDs (5 mg/ml) zugegeben und dann 48 h im Dunkeln gerührt. Die resultierende Lösung wurde in einem Dialysebeutel (MWCO =1000 Da) 24 h lang gegen DI-Wasser dialysiert, um DOX-CDs zu erhalten. Schließlich wurden die DOX-CDs gefriergetrocknet und bei 4 °C gelagert.
Charakterisierung von CDs und DOX-CDs
Die Größenmorphologie von CDs wurde durch Transmissionselektronenmikroskopie (TEM, FEI Tecnai G2 Spirit) charakterisiert. Die PL-Emissionsmessungen wurden an einem LS55-Fluoreszenzspektrophotometer (PerkinElmer, Waltham, MA, USA) durchgeführt. Die Quantenausbeute (QY ) von CDs wurde unter Verwendung einer Chininsulfatlösung in H2 . bestimmt SO4 als Referenz. Die Kristallstruktur wurde mit einem Bruker Tensor27 Fourier-Transform-Infrarot-Spektrophotometer (Pike Corporation, Madison, Wisconsin) beobachtet. Röntgenphotoelektronenspektroskopie (XPS) wurde unter Verwendung eines ESCALAB250Xi-Spektrometers (Thermo, USA) durchgeführt. Das Zeta-Potential wurde mit einem Zeta-Potentiometer (Malvern Panalytical, Malvern, UK) gemessen.
In-vitro-Studie zur Wirkstofffreisetzung
Die in vitro-Wirkstofffreisetzung von DOX aus DOX-CDs wurde unter Verwendung eines Dialysebeutels untersucht. Kurz gesagt wurden DOX-CDs in den Dialysebeutel geladen und in PBS (pH 7,4 bzw. 5,0) eingetaucht, dann wurden sie in einen Schüttelinkubator (37 °C, 100 U/min) gegeben. Zum vorbestimmten Zeitpunkt wurden 0,5 ml Proben entnommen und durch das gleiche Volumen PBS ersetzt. Das freigesetzte DOX wurde durch die Fluoreszenzintensität bei 590 nm aufgezeichnet.
In-vitro-Zytotoxizitätstest
Die Zellzytotoxizität von DOX-CDs wurde mittels MTS-Assay gegen Eierstockkrebszellen HO-8910 und Endothelzellen der Nabelvene EA.hy926 bestimmt [30, 31]. Kurz gesagt, die Zellen wurden in einer 96-Well-Platte mit einer Konzentration von 0,5 × 10 5 . ausgesät Zellen/ml, gehalten für 24 h, um die Zellanhaftung zu ermöglichen. Dann wurden DOX-CDs in verschiedenen Konzentrationen in jede Vertiefung gegeben. Nach 24 h Inkubation wurde das Medium abgesaugt und in jede Vertiefung wurden 90 µl des Mediums und 10 µl MTS gegeben. Nach 4 h wurde die Extinktion bei 490 nm mit einem Mikroplatten-Lesegerät (BioTek Epoch, Service Card) gemessen. Die Lebensfähigkeit der Zellen wurde als Prozentsatz der überlebenden Zellen ausgedrückt und als Mittelwert von Dreifachmessungen angegeben.
In-vitro-Zellbildgebungsstudie
Die Eierstockkrebszellen HO-8910 wurden auf 6-Well-Platten inokuliert und bei 37 °C für 24 h zur Zellanhaftung inkubiert. Dann wurden die Zellen mit DOX-CDs inkubiert, um eine zelluläre Aufnahme zu ermöglichen. Nach 4 Stunden Inkubation wurde das Medium entfernt und die Zellen wurden dreimal mit kaltem PBS gewaschen und mit 4% Paraformaldehyd für 10 Minuten fixiert. Schließlich wurden Morphologie und Fluoreszenzverteilung der Zellen mit einem Fluoreszenzmikroskop (Leica Microsystems, Wetzlar, Hessen, Deutsch) sichtbar gemacht.
In-Vivo-Bildgebung
Tierversuche wurden vom Animal Care Committee der Xuzhou Medical University genehmigt [32]. Balb/c-Nacktmäuse wurden verwendet, um das Potenzial von CDs in der Fluoreszenzbildgebung zu bewerten. Kurz gesagt wurde Balb/c-Nacktmäusen nach intraperitonealer Injektion von 2% Pentobarbital zur Anästhesie an der Injektionsstelle eine wässrige CDs-Lösung (50 μl, 6 mg/ml) subkutan injiziert. Darüber hinaus wurde auch die Bioverteilung der CDs im Körper der Maus untersucht, indem die CDs (5 µg/kg) über die Schwanzvene injiziert wurden. Für die Fluoreszenzmessungen wurden zu verschiedenen Zeitpunkten verschiedene Organe (Herz, Niere, Milz, Leber, Blase) gesammelt. Die Tierfluoreszenzbildgebung wurde auf einem Tanon-5200Multi Gel-Bildgebungssystem aufgenommen, und die Belichtungszeit betrug für alle Fluoreszenzbilder 1,0 s.
In-vivo-Toxizitätsstudie
Kunming-Mäuse (weiblich, 7 Wochen) wurden verwendet, um die Langzeittoxizität von CDs in vivo zu untersuchen. Kunming-Mäuse wurden zufällig in 2 Gruppen eingeteilt:CDs und Kontrollgruppe. Den Mäusen wurden PBS und CDs über die Schwanzvene injiziert (6 µg/kg). Dann wurden die Hauptorgane, einschließlich Herz, Lunge, Niere, Leber und Milz, nach 7 und 21 Tagen Injektion entnommen. Danach wurden die Organe mit 4% Paraformaldehyd fixiert, in Scheiben geschnitten und mit Hämatoxylin und Eosin (H&E) gefärbt. Schließlich wurden die histologischen Schnitte unter einem Lichtmikroskop (Leica Microsystems, Wetzlar, Hessen, Deutsch) betrachtet.
Ergebnisse und Diskussion
Charakterisierung von CDs und DOX-CDs
CDs wurden durch eine einstufige Strategie unter Verwendung von Natriumcitrat-Dehydrat und Harnstoff (Natriumcitrat-Dehydrat/Harnstoff =1/25) bei 200 °C für 1 h hergestellt. DOX wurde kovalent an die Oberfläche präparierter CDs für den Wirkstofftransport konjugiert (Schema 1). Wie das TEM-Bild (Abb. 1a) zeigt, wiesen die CDs eine einheitliche sphärische Morphologie mit einem durchschnittlichen Durchmesser von 2,75 nm und einer relativ engen Größenverteilung auf. Darüber hinaus konnte die Kristallstruktur von CDs durch das hochaufgelöste TEM-Bild (Abb. 1a Einschub) beobachtet werden, was auf eine gute Kristallinität mit deutlichen Gittersäumen hinweist.
Schematische Erstellung von CDs (a ) und DOX-CDs (b )
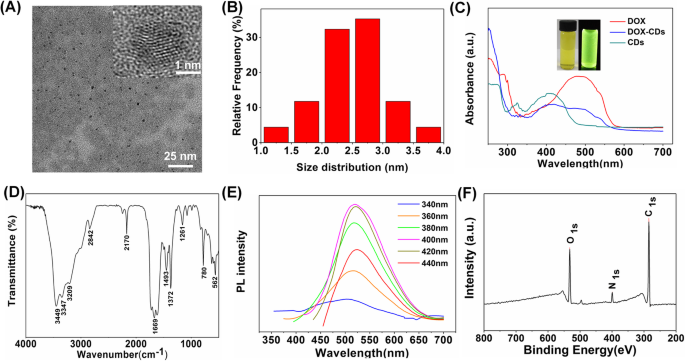
Charakterisierungen von CDs. a TEM-Bilder von CDs (Einschub, hochauflösende TEM-Bilder). b Größenverteilung von CDs. c UV-Vis-Absorption von DOX, CDs und DOX-CDs und eingefügte Bilder zeigen die CDs unter natürlichem Licht und UV-Licht. d FTIR-Spektren von CDs und e Die PL-Emission von CDs mit Anregungswellenlängen von 340 nm bis 440 nm in 20 nm-Schritten. f XPS-Spektrum von CDs
Die chemische Struktur von CDs wurde durch FTIR-Spektroskopie charakterisiert. Wie in Abb. 1d gezeigt, sind die scharfen Peaks bei 3499 cm −1 und 1729 cm −1 –OH bzw. –COOH zugeordnet, während diejenigen bei 780 cm −1 und 1372 cm −1 könnte auf N-H zurückgeführt werden. Daraus kann geschlossen werden, dass sowohl Carboxyl- als auch Aminogruppen auf der Oberfläche der Kohlenstoffpunkte als funktionelle Gruppen existieren und biologische Makromoleküle mit spezifischen Funktionen modifizieren, was eine Möglichkeit für die weitere Anwendungsforschung der Kohlenstoffpunkte bietet.
Darüber hinaus wurden die optischen Eigenschaften von CDs mittels UV-Vis-Absorption und PL-Spektroskopie untersucht. Wie in Fig. 1c gezeigt, zeigten die CDs einen Absorptionspeak bei 410 nm, und DOX zeigte einen Absorptionspeak bei 500 nm. Dagegen hielten die DOX-CDs die Absorptionspeaks von CDs und DOX bei 410 nm bzw. 500 nm, was auf die erfolgreiche Konjugation von DOX an CDs hinweist. Darüber hinaus zeigte sich, wie in der Einschubfigur von Fig. 1c gezeigt, die wässrige DOX-CDs-Lösung unter natürlichem Licht hellgelb und transparent und nussig wurde unter UV-Anregung hellgrün. Darüber hinaus wurde die Fluoreszenzquantenausbeute mit 93% berechnet, wobei Chininsulfat als Referenz verwendet wurde (QY =54%). Da CDs bei Wellenlängen von 340 bis 440 nm angeregt wurden, zeigte der PL-Peak fast keine Verschiebung, was auf die anregungsunabhängigen Emissionseigenschaften von CDs hinweist. Die maximale Anregungswellenlänge und der PL-Peak der CDs betragen 400 bzw. 525 nm. Das anregungsunabhängige PL-Verhalten kann aus den einheitlichen Oberflächenzuständen von CDs resultieren [33].
Darüber hinaus wurde die elementare Zusammensetzung von CDs durch XPS bestimmt. Wie in Abb. 1f gezeigt, hat das XPS-Spektrum festgestellt, dass die CDs hauptsächlich aus Kohlenstoff (C ), Stickstoff (N ) und Sauerstoff (O ) und das entsprechende Atomverhältnis davon getrennt 78,39 %, 7,52 % und 14,1 % betrug. Drei typische Peaks von C 1S , N 1S , und O 1S kann bei 284,8, 399,5 bzw. 532,6 eV beobachtet werden. Um genau zu sein, C 1S Spektrum zeigte 3 Peaks bei 284.8, 286.7 und 288.3 eV, die die Existenz von C–C-, C–N-, C–O- oder C=O-Bindungen separat darstellen (Abbildung S1A). Das hochauflösende Spektrum für N 1S zeigte einen Peak bei 399.5 eV, der C–N zugeordnet wurde. Außerdem ist das O 1s Das Spektrum bestätigte auch das Vorliegen von C=O- und C-O-Bindungen bei 531.9 bzw. 532.6 eV (Abbildung S1B).
Die Fluoreszenzintensität von CDs blieb sowohl bei 4 °C als auch bei Raumtemperatur wunderbar stabil (Abbildung S2A). Die Abnahme der Fluoreszenzintensität bei 4°C in 2 Wochen für weniger als 10% kann vernachlässigt werden. Daher wird erwartet, dass die Kohlenstoffpunkte eine Langzeitstabilität besitzen, um als biomedizinisches Bildgebungsmittel verwendet zu werden.
Abbildung S2B zeigt, dass die PL-Intensitäten von CDs in wässrigen Lösungen mit hohem (> 10) oder niedrigem (<3) pH-Wert abnahmen. Trotzdem war die PL-Intensität in einer wässrigen Lösung mit pH 3–10 stabil. Die so hergestellten CDs, die beim Biomarking und Bioimaging verwendet werden, müssen mit Zellen koinkubiert werden, deren pH-Bedingung ungefähr neutral ist (pH =6–8), was die PL-Stabilität garantiert. Theoretisch deutete dies darauf hin, dass die präparierten CDs Fluoreszenz mit hoher Stabilität in Zellen für Biomarking und Bioimaging emittieren können.
Um die Fluoreszenzstabilität von CDs zu klären, wurde der Fluoreszenz-Anti-Photobleaching-Test durchgeführt. Wie in Abbildung S2C gezeigt, zeigten die Kohlenstoffpunkte im Vergleich zu den Quantenpunkten (CdTe) und den herkömmlichen Fluoreszenzfarbstoffen (DAPI) nicht nur eine höhere Fluoreszenzintensität, sondern auch eine ausgezeichnete Beständigkeit gegen Photobleichen. Außerdem waren die CDs auch in verschiedenen Lösungen wie DI-Wasser, PBS, FBS-Medium, DMEM-Medium und CM1-1-Medium gut dispergiert, was eine ausgezeichnete Stabilität im Blutsystem erwartet (Abbildung S3).
Die CDs wiesen ein Zetapotential von −31,1 mV auf (Abbildung S4), was auf die Existenz von Sauerstoff- und Carboxylgruppen auf der Oberfläche dieser Partikel zurückgeführt werden kann. Das potentiell positiv geladene DOX kann über elektrostatische Wechselwirkung mit der Carboxylgruppe und hydrophobe Wechselwirkung physikalisch an die Oberfläche von CDs gebunden werden. DOX-CDs weisen ein Zetapotential von −9,7 mV auf, was die Herstellung der DOX-CD-Komplexe bestätigt. Außerdem enthalten die CDs ein sp 2 -Kohlenstoffnetzwerk, das die aromatische Struktur von DOX über starkes π . laden kann -π Interaktionen. Die optimale Verkapselungseffizienz und Wirkstoffbeladungseffizienz wurden durch verschiedene Konzentrationen von DOX untersucht. Wie in Abbildung S5 gezeigt, wurde die maximale Verkapselungseffizienz mit 50,82 % mit der entsprechenden Beladungseffizienz von 6,82 % bei 0,1 mg/ml DOX berechnet.
In-vitro-Wirkstofffreisetzung von DOX-CDs
Das in vitro DOX-Freisetzungsverhalten von DOX-CDs wurde in PBS durchgeführt, um die pH-sensitive DOX-Freisetzung zu untersuchen. Um dies zu demonstrieren, wurden die DOX-CDs bei verschiedenen pH-Werten (pH 7,4, 6,0 und 5,0) inkubiert und die Freisetzung von DOX überwacht. Wie in Fig. 2 gezeigt, zeigten die DOX-CDs Profile mit anhaltender Freisetzung bei pH 7,4, 6,0 und 5,0 während der Ruheperiode. Die Ergebnisse zeigten, dass die DOX-Freisetzung pH-abhängig war. Nur 13% DOX wurden innerhalb von 8 h freigesetzt, wenn die DOX-CDs bei pH 7,4 inkubiert wurden. Wenn der pH-Wert jedoch auf 6,0 oder 5,0 gesenkt wurde, wurden mehr als 35% bzw. 65% DOX aus den DOX-CDs freigesetzt, was auf die Empfindlichkeit der DOX-CDs gegenüber dem niedrigen pH-Wert hindeutet. Es zeigte sich, dass die Menge an freigesetztem DOX bei einem niedrigeren pH-Wert zunahm, was auf eine erhöhte Protonierung von –NH2 . zurückgeführt wurde Gruppen auf DOX in einer sauren Umgebung. Daher können die DOX-CDs das vorzeitige Austreten von DOX während der Blutzirkulation verhindern und die intrazelluläre Wirkstofffreisetzung verbessern. Es ist von großem Nutzen für die wirksame Behandlung von Krebs.
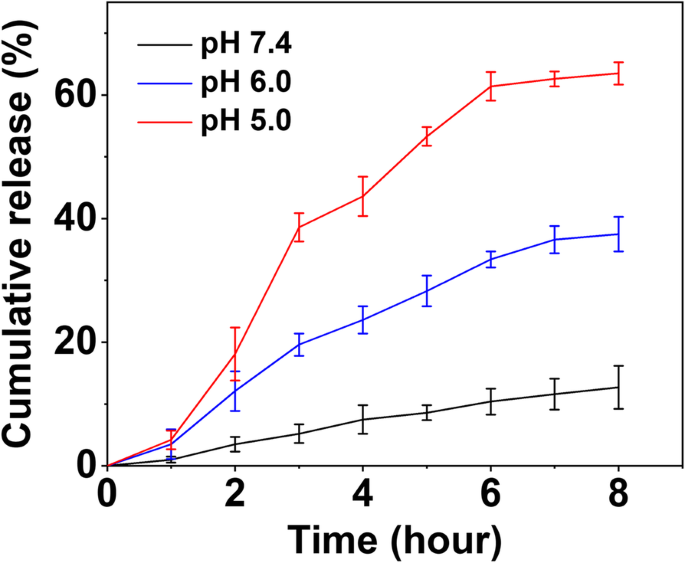
In-vitro-DOX-Freisetzungsprofil von DOX-CDs bei pH 5,0, 6,0 und 7,4
In-vitro-Zytotoxizitätstest
Die Frage der Biokompatibilität ist für die CDs für die Anwendung in der biomedizinischen Bildgebung und Arzneimittelabgabe kritisch. Die Zytotoxizität von CDs in verschiedenen Konzentrationen wurde gegen HO-8910 Eierstockkrebszellen und EA.hy926 Nabelvenen-Endothelzellen durchgeführt. Wie in Fig. 3a dargestellt, behielten sowohl die HO-8910- als auch die EA.hy926-Zellen selbst bei einer hohen Konzentration von 5 mg/ml eine hohe Lebensfähigkeit von über 85%, was auf die ausgezeichnete Biokompatibilität und geringe Zytotoxizität von CDs hinweist.
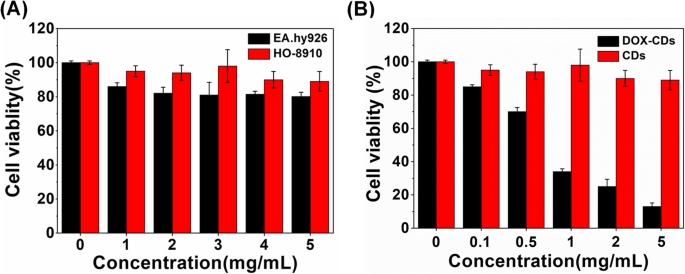
In-vitro-Zellzytotoxizität. a Biokompatibilität von CDs gegen HO-8910- und EA.hy926-Zellen. b Zellzytotoxizität von DOX-CDs und CDs gegen HO-8910 Tumorzellen. Die Werte werden als Mittelwert ± SD ausgedrückt (n =3)
In Kombination mit DOX zeigten die DOX-CDs eine DOX-konzentrationsabhängige Zelllebensfähigkeit gegen die Eierstockkrebszellen HO-8910. Wie in Abb. 3b gezeigt, war die Zelllebensfähigkeit der DOX-CDs signifikant niedriger als die von DOX-freien CDs, insbesondere wenn die DOX-Konzentration über 0,05 mg/ml lag, was auf eine ausgezeichnete Antikrebswirkung von DOX-CDs hinweist.
In-vitro-Studie zur zellulären Aufnahme und Markierung
Um die intrazelluläre Aufnahmefähigkeit von DOX-CDs zu bewerten, wurde die zelluläre Bildgebung an den HO-8910-Zellen untersucht. Wie in Fig. 4 dargestellt, wurde eine lebhafte grüne und rote Fluoreszenz innerhalb der Krebszellen beobachtet, die der Anwesenheit von CDs bzw. DOX zugeschrieben werden. Insbesondere ein intensives grünes Fluoreszenzsignal, das hauptsächlich im Zytoplasma lokalisiert ist, was auf die intrazelluläre Verteilung der CDs hinweist. Umgekehrt war das rote Signal in den Zellkernen im Vergleich zum Zytoplasma signifikant stärker, was darauf hindeutet, dass das DOX mit den CDs diskonjugiert und direkt zu den Zellkernen wandert, was auf seine hohe Affinität mit der DNA zurückzuführen ist. Es könnte erklärt werden, dass der niedrige pH-Wert (5,0) im Endosom und Lysosom die DOX-Freisetzung aus den DOX-CDs unterstützen könnte. Daher könnten die DOX-CDs ein vielversprechender Wirkstoff für die Zellmarkierung und den intrazellulären Wirkstofftransport sein.
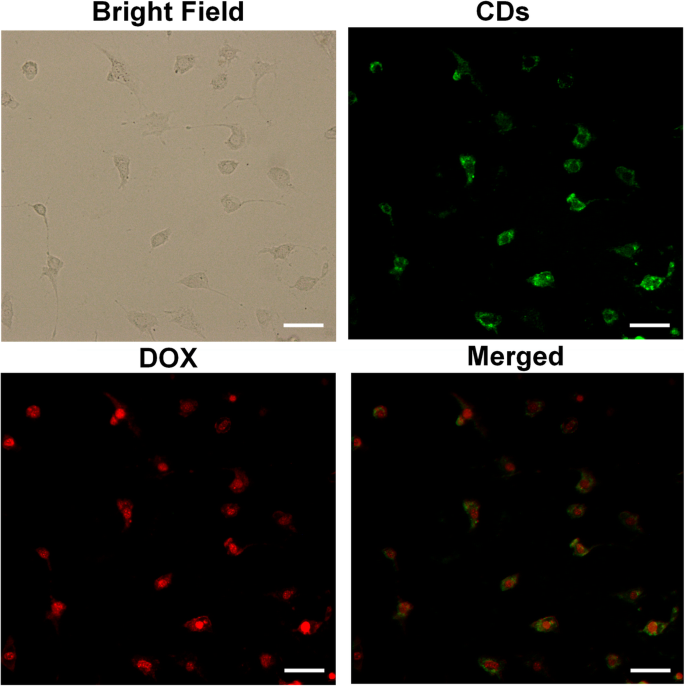
In-vitro-Zellaufnahme von DOX-CDs durch HO-8910-Zellen. Maßstabsbalken =50 μm
In-vivo-Tierbildgebungsstudie
Einer Nacktmaus wurde eine wässrige CDs-Lösung (50 μl, 6 mg/ml) subkutan verabreicht. Die Maus wurde dann durch intrapertoneale Injektion von 1% Pentobarbital anästhesiert und mit einem Tanon-5200Multi Gel-Bildgebungssystem unter 488 nm Anregungslicht und einem 535 nm Emissionsfilter abgebildet. Wie in Fig. 5a gezeigt, wurde an der verabreichten Stelle eine starke grüne Fluoreszenz beobachtet, was impliziert, dass die Fluoreszenz der CDs Haut und Gewebe von Mäusen effektiv durchdringen konnte. Darüber hinaus blieb die Maus nach den Injektionen gesund, was darauf hindeutet, dass die CDs eine ausgezeichnete Biokompatibilität und eine geringe Toxizität für Tiere aufwiesen. Unter Berücksichtigung aller Ergebnisse waren die CDs als hervorragende Lumineszenzsonde für die Biobildgebung in vitro und in vivo geeignet.
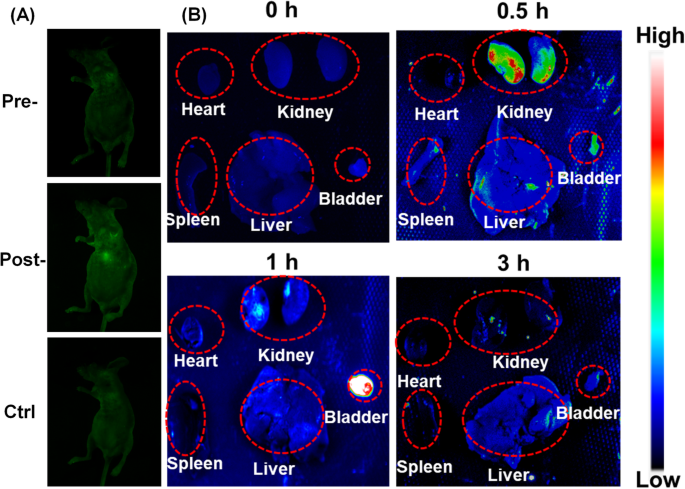
In-vivo-Tierversuch. a Tierfluoreszierende Bildgebung mit CDs. b Ex-vivo-Bildgebung der Mäuse nach intravenöser Injektion von CDs zu verschiedenen Zeitpunkten
Darüber hinaus wurden die Bioverteilung und der Ausscheidungsweg der CDs durch Injektion der Nanosonde über die Schwanzvene durchgeführt. Zu verschiedenen Zeitpunkten (0, 0,5, 1, 3 h) wurden verschiedene Organe für die Fluoreszenzbildgebung seziert. Wie in 5b gezeigt, zeigten die Niere und Blase im Vergleich zu anderen Organen, einschließlich Herz, Milz und Leber, nach der Injektion ein viel stärkeres Fluoreszenzsignal. Darüber hinaus nahm das Fluoreszenzsignal in der Niere innerhalb von 0,5 h nach der Injektion signifikant zu und nahm nach 1 h allmählich ab. Dann stieg das Fluoreszenzsignal in der Blase allmählich von 0,5 h auf 1 h an, was darauf hindeutet, dass die CDs von der Niere an die Blase abgegeben wurden. Das Ergebnis zeigte, dass die CDs durch das Nieren- und Blasensystem ausgeschieden und beseitigt werden konnten.
In-vivo-Langzeit-Toxizitätstest
Darüber hinaus wurde auch eine In-vivo-Langzeittoxizitätsstudie durchgeführt, um das Potenzial des Einsatzes von CDs in der klinischen Forschung vollständig zu untersuchen. Den Kunming-Mäusen wurde über die Schwanzvene PBS und CDs injiziert, und Hauptorgane (Herz, Lunge, Niere, Leber, Milz) wurden nach 7 und 21 Tagen zur histologischen Analyse entnommen. Anschließend wurden Figuren histologischen Gewebes mit einem Mikroskop abgebildet, um den pathologischen Unterschied zwischen den experimentellen Gruppen und der Kontrollgruppe zu bewerten. Wie in Fig. 6 gezeigt, wurden in den Hauptorganen von Tieren, denen CDs verabreicht wurden, keine bemerkenswerten Organschäden und entzündlichen Läsionen beobachtet, was darauf hindeutet, dass die so hergestellten CDs für die klinische Verwendung und in-vivo-Studien sicher waren. Daher waren die so synthetisierten grünen CDs als Biomarker und Bioimaging-Sonde biokompatibel.
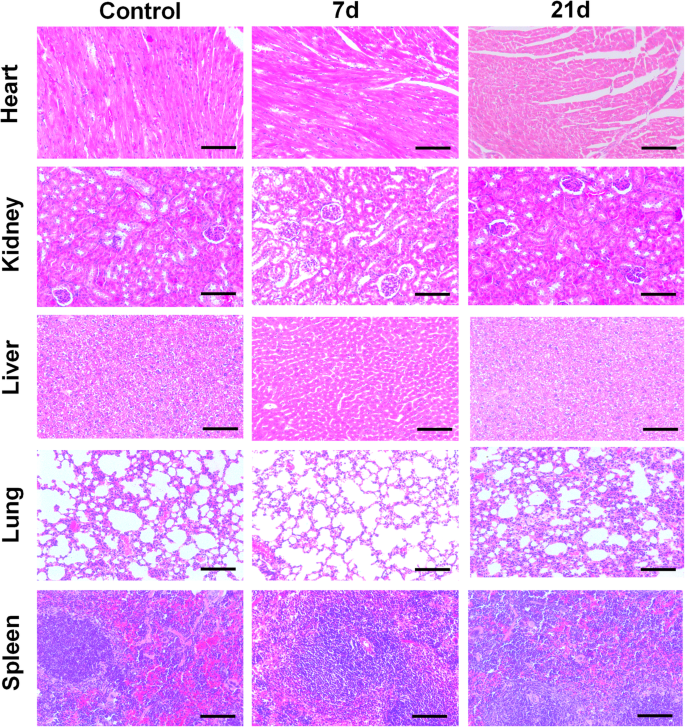
Histologische Analyse der wichtigsten Organe nach 7- und 21-tägiger Verabreichung von CDs. Maßstabsbalken =100 μm
Schlussfolgerung
Zusammenfassend hat diese Arbeit eine kostengünstige Herstellung grün fluoreszierender CDs mit hohem QY . gezeigt von 93% für Bioimaging und verbesserte intrazelluläre Arzneimittelabgabe. DOX wurde erfolgreich an die CDs konjugiert, um die DOX-CDs mit guter Kristallstruktur, bemerkenswerter wässriger Stabilität und ausgezeichneten Photolumineszenzeigenschaften zu bilden. Die DOX-CDs könnten auf die intrazellulären pH-Umgebungen reagieren, um eine durch Säure ausgelöste intrazelluläre Freisetzung zu fördern. Aufgrund der pH-Empfindlichkeit zeigten die DOX-CDs eine wirksame Hemmung der Proliferation von HO-8910-Zellen. Die DOX-CDs zeigten eine ausgezeichnete Fähigkeit zur Zellmarkierung und reagierten auf den endo-/lysosomalen pH, um das DOX in den Zellen freizusetzen. Die CDs fungierten sowohl in vitro als auch in vivo als fluoreszierende Sonden. Schließlich wurde bei den mit CD behandelten Mäusen bei der histologischen Analyse keine bemerkenswerte toxische Wirkung beobachtet. Nichtsdestotrotz zeigte die Arbeit, dass CDs, die mit der kosteneffektiven Methode hergestellt wurden, ein großes Potenzial für die biomedizinische Bildgebung und den intrazellulären Wirkstofftransport haben können.
Verfügbarkeit von Daten und Materialien
Alle während dieser Studie generierten oder analysierten Daten sind in diesem veröffentlichten Artikel und seinen ergänzenden Informationsdateien enthalten.
Abkürzungen
- CDs:
-
Karbonpunkte
- DOX:
-
Doxorubicin
- DOX-CDs:
-
In Doxorubicin eingeschlossene Kohlenstoffpunkte
- FBS:
-
Fötales Rinderserum
- MTS-Assay:
-
MTS-Kit für kolorimetrische Zellproliferation
- PBS:
-
Phosphatgepufferte Kochsalzlösung
- QY :
-
Quantenausbeute
- TEM:
-
Transmissionselektronenmikroskopie
- XPS:
-
Röntgenphotoelektronenspektroskopie
Nanomaterialien
- Nanofasern und Filamente für eine verbesserte Wirkstoffabgabe
- 131I-gespurte PLGA-Lipid-Nanopartikel als Wirkstoffträger für die gezielte chemotherapeutische Behandlung von Melanomen
- Silica-Nanopartikel für die intrazelluläre Proteinzufuhr:ein neuartiger Syntheseansatz unter Verwendung von grün fluoreszierendem Protein
- Die Herstellung einer Au@TiO2-Dotter-Schale-Nanostruktur und ihre Anwendungen für den Abbau und den Nachweis von Methylenblau
- Ein einfacher Ansatz zur Synthese von fluoreszierenden Kohlenstoffquantenpunkten aus Tofu-Abwasser
- Eine wiederaufladbare Fluoreszenzsonde BHN-Fe3O4@SiO2 Hybrid-Nanostruktur für Fe3+ und ihre Anwendung in der Biobildgebung
- Platycodon-Saponine aus Platycodi Radix (Platycodon grandiflorum) für die grüne Synthese von Gold- und Silber-Nanopartikeln
- Einfache Eintopf-Synthese von Polydopamin-Kohlenstoffpunkten für die photothermische Therapie
- Schwefelsäureunterstützte Herstellung von rot emittierenden karbonisierten Polymerpunkten und Anwendung von Bio-Imaging
- Photothermal/pH Dual-Responsive Drug Delivery System von aminoterminiertem HBP-modifiziertem rGO und der chemophotothermischen Therapie von Tumorzellen



