Dialektische Beobachtung von kontrollierbaren galvanisch abgeschiedenen Ni-Nanokegeln:die Vereinigung von lokaler Störung und Gesamtordnung
Zusammenfassung
Dichte und geordnete Ni-Nanokegel mit regelmäßigen spiralförmigen Texturen wurden erfolgreich durch ein einfaches und kostengünstiges Elektroabscheidungsverfahren in einer Lösung mit Natriumchlorid (NaCl), Nickelchlorid-Hexahydrat (NiCl2) synthetisiert ·6H2 O) und Borsäure (H3 BO3 ). Nach Analyse der Mikrostruktur wurde ein optimierter möglicher Wachstumsmechanismus von Ni-Nanokonen vorgeschlagen, bei dem der Wachstumsprozess in lokale und globale Aspekte unterteilt wurde, die als multidimensionaler Wachstumsmechanismus der globalen Ordnung und der lokalen Unordnung bezeichnet werden. In einem Bereich, der klein genug ist, würden alle subtilen Zustandsänderungen eine Unordnung der Ni-Atomanordnung verursachen, die die lokale Mikrostruktur ungeordnet erscheinen ließ, aber aus einer Makroperspektive war der Unterschied zwischen zwei benachbarten Störungen, die durch unterschiedliche Zustände verursacht wurden, zu klein, um gut reflektiert zu werden. nur wenn der Zustandsunterschied groß genug war, kann die Änderung im makroskopischen Erscheinungsbild beobachtet werden, so dass das Globale geordnet war. In der Zwischenzeit fanden wir heraus, dass die Mikrostruktur von Ni-Nanokonen in der Elektrotauchlacklösung durch Anpassen der experimentellen Parameter wie der Konzentration von NaCl, NiCl2 . gesteuert werden kann ·6H2 O und H3 BO3 , die indirekt über die Steuerung der Zwischenproduktbildung und des pH-Wertes die Mikrostruktur maßgeblich bestimmt.
Einführung
Nanostrukturierte Metalle mit einzigartigen Oberflächen [1] wurden in einer Vielzahl von Bereichen verwendet, wie z. B. Oberflächenmodifizierung [2], ultrahydrophobe Schichten [3,4,5], Superkondensatoren [6], mikroelektronische Verbindungen [7], Nanosonden [ 8], Solarzellen [9], Gassensoren [10, 11], Katalysatoren [12,13,14,15,16,17,18,19], mechanische Polierschlämme [20], Diamantscheiben [21], Nanoskala Präzisionsoberflächen [22, 23]. Als Ergebnis wurden viele Präparationstechniken für nanostrukturierte Metalloberflächen vorgeschlagen, darunter hydrothermale Verfahren [10, 11], Sol-Gel-Verfahren [24], Templatverfahren [25], chemische Gasphasenabscheidungsverfahren [26], chemische Reduktionsverfahren [ 27] und Mikroemulsionsmethode [28]. Diese traditionellen Methoden erforderten jedoch viel Zeit und Kosten [2, 29].
Um die oben erwähnten Mängel traditioneller Herstellungsverfahren zu überwinden, hat die Elektrotauchlackierungstechnologie ein bedeutendes Forschungsinteresse auf sich gezogen und großartige Entwicklungen erlebt. Es würde auch unter den milderen Bedingungen die Zielerwartung erreichen, denn das elektrische Feld könnte die Reaktionsgeschwindigkeit erhöhen [2]. Die Herstellung von galvanisch abgeschiedenen nanostrukturierten Metalloberflächen erforderte keine aufwendigen Hilfsmittel, was den Zeit- und Kostenaufwand stark reduzierte. Daher wurde viel über die Herstellungstechnologie und den Bildungsmechanismus der nanostrukturierten Metalloberflächentopographie durch galvanische Abscheidung geforscht [30].
Bei der spezifischen Elektrotauchlackierung von nanostrukturierten Metalloberflächen war die Methode der Kristallmodifizierer die repräsentativste Methode [31]. Die Zugabe von Kristallmodifikatoren könnte die Wachstumsrichtung der Kristalle beeinflussen, so dass die nanostrukturierte Metalloberfläche bei Reaktion mit einer Elektrotauchlacklösung, die einen bestimmten Kristallmodifikator enthält, in eine bestimmte Richtung wachsen würde. Daher könnte die Verwendung von Kristallmodifikatoren leicht eine spezifische, eng beabstandete und regelmäßige 3D-Nanostruktur auf der Oberfläche des Metallsubstrats erhalten [32].
Wenn eine bestimmte Menge Ammoniumchlorid (NH4 Cl), der am häufigsten verwendete Kristallmodifikator, wurde der Ni-Elektroabscheidungslösung, dem NH4 ., zugesetzt + würde komplexe Ionen mit Ni 2+ . bilden und Veranlassen, dass der galvanisch abgeschiedene Ni-Kristall entlang der (111)-Kristallfläche wächst. Daher durch Hinzufügen von NH4 Cl, war es einfach, Ni-Nanokonen, die in einer bestimmten Richtung auf der Substratmetalloberfläche wachsen, galvanisch abzuscheiden und dieses Phänomen anhand des Wachstumsmechanismus der Schraubenversetzung genauer zu erklären [33]. Darüber hinaus hatte Nickel als gut ferromagnetisches leitfähiges Metall die Vorteile eines niedrigen Preises, einer breiten Verwendung und einer ausgezeichneten Korrosionsbeständigkeit [34]. Ni-Nanokegel, erhalten durch Elektrotauchlackierung mit einer NH4 .-haltigen Lösung Cl hatte wichtige Anwendungen in gasempfindlichen Sensoren [10, 11], ultrahydrophoben Oberflächen [3,4,5] und Katalysatoren [12,13,14,15,16,17,18,19].
In dieser Arbeit haben wir NH4 . ersetzt Cl mit NaCl als Kristallmodifikator und stellten erfolgreich Ni-Nanocones her. Im Vergleich zu NH4 Cl, NaCl war ungiftig, sanft und stabil. Darüber hinaus stellen wir die mögliche spezifische komplexe Struktur und ihre Rolle im Prozess der Elektroabscheidung vor, indem wir Hybridorbitaltheorie, Molekülbahntheorie und aktuelle Charakterisierungsergebnisse kombinieren. Der Wachstumsmechanismus von Ni-Nanokonen, die in einer NaCl-haltigen Lösung galvanisch abgeschieden wurden, der sich stark von dem üblichen durch Schraubenversetzungen angetriebenen Kristallwachstumsmechanismus [35] unterschied, wurde erläutert und die Auswirkungen der Galvanisierungszeit und der Konzentration von NaCl, NiCl2 , und H3 BO3 zur Nanostruktur von Ni-Nanocones wurden analysiert. Durch die Analyse von Faktoren, die durch die Nanostruktur von Ni-Nanokonen beeinflusst werden, wurde die kontrollierte Präparation vorläufig realisiert, die für die zukünftige Herstellung anderer speziell geformter Ni-Nanokonen aufschlussreich sein würde.
Materialien und Methoden
Materialien
Alle chemischen Reagenzien waren analysenrein und konnten direkt für chemische Reaktionen verwendet werden. Die Länge, Breite und Dicke der in unserem Experiment verwendeten Ni-Tabletten (Kathode und Anode) betrugen 70 mm, 25 mm bzw. 0,08 mm. Natriumchlorid (NaCl), Nickelchlorid-Hexahydrat (NiCl2 .) ·6H2 O), Borsäure (H3 BO3 ), Salzsäure (HCl) und wasserfreies Ethanol (CH3 CH2 OH) wurden von ChengDu Chron Chemicals Co., Ltd., China, bezogen.
Oberflächenbehandlung und Probenvorbereitung
In einem Standardverfahren wurden zwei Ni-Tabletten (Kathode und Anode) in entionisiertem Wasser bzw. Ethanol mit Ultraschall gereinigt. Die Kathoden-Ni-Tablette wurde in HCl (25 Gew.-%, 60 °C) 30 min lang aufgerauht. Anschließend wurden Ni-Nanokonen auf den so hergestellten Ni-Tabletten (Kathode) aus einer wässrigen Lösung, die NiCl2 . enthielt, galvanisch abgeschieden ·6H2 O (200 µg/l), NaCl (100 µg/l) und H3 BO3 (50 µg/l). Die Temperatur (60 °C), Stromdichte (0,1 A) und Elektroabscheidungszeit (20 min) sollten reguliert werden und eine weitere Ni-Tablette wurde als Anode verwendet, um Ni-Ionen (Ni 2+ ). Nach der Elektroabscheidung wurde die Kathode mit Ultraschall in entionisiertem Wasser und dann in Ethanol gereinigt und schließlich jeweils 30 min im Ofen getrocknet. Zum weiteren Vergleich wurde die Elektroabscheidungszeit von 5 min bis 50 min gesteuert und die Konzentration von NaCl, NiCl2 ·6H2 O und H3 BO3 wurde von 0 auf 167 µg/l, 0 auf 400 µg/l bzw. 0 auf 50 µg/l geändert (Tabelle 1).
Charakterisierung
Die Bilder des Rasterelektronenmikroskops (REM) und die entsprechende energiedispersive Spektroskopie (EDS) wurden durch FEI Inspect F50 (Thermo Fisher, USA) bei 20 kV betrieben. Die Röntgenbeugungsmuster (XRD) wurden unter Verwendung eines Röntgendiffraktometers D8 Advance (BRUKER, Deutschland) mit einer Cu Kα-Strahlung (λ =1,5406 Å). Das Fourier-Transform-Infrarotspektroskopie-(FTIR)-Muster wurde unter Verwendung eines Nicolet iS 10 (Thermo Fisher, USA) mit einem ATR-Modul gemessen.
Ergebnisse und Diskussion
Bestimmung von Zwischenprodukten
Normalerweise, wenn NH4 Als Kristallmodifikator wurde Cl verwendet, das NH4 + würde mit dem Ni 2+ . komplexe Ionen bilden während des Elektrotauchprozesses [36]. Wenn NaCl als Kristallmodifikator verwendet wurde, könnte die Lösung daher komplexe Ionen erzeugen, die die Durchführung der Elektroabscheidung fördern könnten. Abbildung 1 zeigt die XRD-Muster der Elektrotauchlacklösung, die mit einer Alkohollampe (Abb. 1a) bzw. mit einem Ofen (60 °C) (Abb. 1b) erhitzt und getrocknet wurden, und das FTIR-Muster der Elektrotauchlacklösung (Abb. 1c) nach der galvanischen Abscheidung. In Abb. 1a konnten wir deutlich fünf verschiedene Peaks sehen, nämlich NaCl (111), (200), (220), (222) bzw. (400), verglichen mit einer XRD-Standard-PDF-Karte. Dies deutete darauf hin, dass die chemischen Bindungen des Zielprodukts nach der Behandlung der Elektrotauchlacklösung bei hohen Temperaturen (Alkohollampe) aufgebrochen worden waren, mit anderen Worten, das Zielprodukt war beständig gegen eine schlechte Hochtemperaturleistung. Danach erhitzten und trockneten wir die Elektrotauchlackierungslösung bei einer niedrigeren Temperatur (60 °C, Ofen), und das resultierende XRD-Muster wurde in Abb. 1b gezeigt. Leider würde im Vergleich zu den XRD-Standard-PDF-Karten für alle möglichen Verbindungen nichts diesen Spitzen entsprechen. Dies deutete darauf hin, dass das resultierende Zielprodukt keine allgemeine allgemeine Verbindung war, sondern ein seltener und besonderer Komplex sein könnte. Abbildung 1c zeigt das FTIR-Muster der Elektrotauchlacklösung nach der Elektrotauchlackierung, wobei wir einen Peak bei etwa 1500 cm −1 . finden konnten , was mit dem charakteristischen Peak übereinstimmt (1499 cm −1 ), dass die Ni-Halogenid-Anion enthaltende ionische Flüssigkeit [37] aufwies. Daher haben wir in Kombination mit XRD- und FTIR-Mustern angenommen, dass einige komplexe Ionen ([Nix Cly ] z− ), die nach der Reaktion noch vorhanden waren und eine schlechte Hochtemperaturbeständigkeit aufwiesen, wurden während des Elektroabscheidungsprozesses in der Lösung erzeugt.
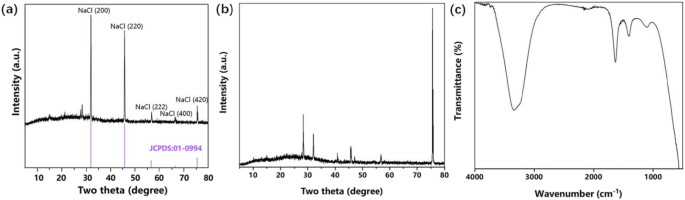
Die XRD-Muster der Elektrotauchlacklösung, die erhitzt und mit einer Alkohollampe getrocknet wurden (a ) und mit Backofen (60 °C) (b ). Das FTIR-Muster der Elektrotauchlacklösung (c ) nach der galvanischen Abscheidung
Wenn Cl − auf Ni 2+ . gestoßen in der Lösung Ni 2+ würden nach der Hybridorbitaltheorie hybridisiert und bilden [Ni(H2 O)2 ]Cl4 . Nach Fernandes et al. würden die Wassermoleküle bei einer Temperatur über 30 °C durch Cl − . ersetzt . Nach der Molekülorbitaltheorie ist jedes einsame Paar von Cl − nicht eine einzelne Bahn einnahm, sondern alle vier Bahnen gleichmäßig aufteilte, trat der Übergang von einem oktaedrischen zu einem tetraedrischen Komplex auf [38]. Somit war jedes einzelne Elektronenpaar sowohl in der Anzahl als auch in der Energie der besetzten Bahnen konsistent, und theoretisch ergab sich das resultierende [NiCl4 ] 2− präsentierte eine Struktur eines regelmäßigen Tetraeders im Raum.
Effekt der Elektroabscheidungszeit und des Kristallmodifikators
Abbildung 2 zeigt niedrig (Abb. 2 a1 –c1 ) und hoch (Abb. 2a2 –c2 ) Vergrößerungs-REM-Aufnahmen von Ni355 /Ni370 /Ni400 Nanocones mit unterschiedlicher Elektrotauchlackierzeit (5 min, 20 min, 50 min) , XRD und EDS (Abb. 2 b3 , b4 ) Muster von typischem Ni370 Nanokegel (Abb. 2b1 ), bzw. Aus den REM-Bildern war klar, dass die Kathodenoberfläche durch eine kurze Elektrotauchlackierungszeit (5 min) mit einer kleinen und dichten plattenartigen Struktur bedeckt war und sich mit zunehmender Elektrotauchlackierungszeit (20 min) allmählich Nanokonusstrukturen bildeten. Bei weiter gewachsenen Nanokegeln waren die scharfen Ecken klarer und strukturierter für längere Zeiträume der Elektroabscheidung (50 min). Aus dem XRD-Muster war klar, dass es drei verschiedene Beugungspeaks gab, und alle stimmten mit einer reinen Ni-Phase mit einer kubisch-flächenzentrierten (fcc) Struktur überein, und keine anderen Verunreinigungspeaks wie NiO oder Ni(OH)2 festgestellt werden konnte. Inzwischen war offensichtlich, dass Ni hauptsächlich entlang der (220)-Kristallfläche wuchs. Wie aus dem EDS-Muster von typischem Ni370 . ersichtlich ist Nanokegel, nur Au und Ni konnten bestätigt werden, was darauf hindeutet, dass das, was auf der Kathode galvanisch abgeschieden wurde, reines Ni370 . war Nanokegel ohne jegliche Kontamination (Ni war ein magnetisches Material, um magnetisch zu dämpfen und die Sonde zu schützen, musste es während der REM-Charakterisierung mit Gold besprüht werden).
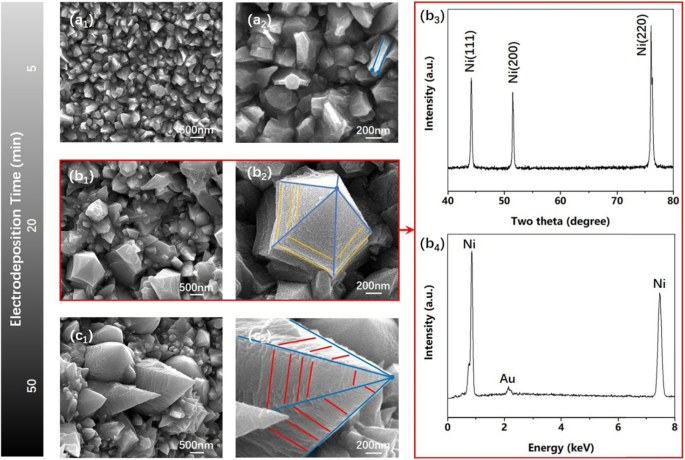
REM-Aufnahmen mit geringer Vergrößerung der Oberflächenmorphologie von Ni-Nanokegeln mit unterschiedlicher Elektroabscheidungszeit (a 1 , b 1 , c 1 ) und ihre hochvergrößerten REM-Bilder (a 2 , b 2 , c 2 ), bzw. XRD-Muster (b 3 ) und EDS-Muster (b 4 ) von Ni370 Nanokegel
Abbildung 3 zeigt den spezifischen Wachstumsmechanismus von Ni370 Nanokegel, genannt multidimensionaler Wachstumsmechanismus globaler Ordnung und lokaler Unordnung. Am Anfang [NiCl4 ] 2− in der Lösung, die sich unter der Einwirkung des elektrischen Feldes zur Kathode bewegt, Cl − mit negativer Elektrizität im [NiCl4 ] 2− erzeugte eine Abstoßungskraft gegen Elektronen an der Kathode, während Ni 2+ mit positiver Elektrizität wurden nach dem Eintritt in die Diffusionsschicht von der Kathode angezogen. Sowohl abstoßende als auch anziehende Kräfte nahmen nach Eintritt in die Helmholtz-Doppelschicht signifikant zu, die koordinativen kovalenten Bindungen (Ni-Cl) von [NiCl4 ] 2− wurden gebrochen, und dann das wieder freigesetzte Cl − (Cl in den gebrochenen Ni-Cl-Bindungen) bewegte sich gegen die Kathode, während das wieder freigesetzte Ni 2+ (Ni in den gebrochenen Ni-Cl-Bindungen) bewegte sich zur Kathode. Befreie Ni 2+ bewegten sich parallel über die Kathode und wählten die einfachste Anbringungsstelle, normalerweise an den Defekten und an den Stufen, für das galvanische Wachstum von Ni. Während des 2D-Wachstums von Ni auf der Kathode würden unweigerlich Defekte (normalerweise Kavitätendefekte und Wulstdefekte) auftreten, die das Wachstum von 2D auf 3D umwandeln (die Auswirkungen von Defekten auf das flache Wachstum wurden hier nicht berücksichtigt, sondern die Auswirkungen auf die z -Achsenrichtungswachstum). Idealerweise war die Wahrscheinlichkeit, dass eine neue Schicht in jede Richtung wächst, die durch einen einzelnen Defekt verursacht wird, gleich, mit anderen Worten, die neue Schicht sollte kreisförmig nach außen wachsen (die Auswirkungen von Defekten auf z Wachstum in -Achsenrichtung wurde hier nicht berücksichtigt, aber die Auswirkungen auf das flache Wachstum). Was wir jedoch aus Abb. 2 b2 gesehen haben, und c2 waren Pyramiden und keine kreisförmigen Kegel, weil das Wachstum einer neuen Schicht immer noch von einer großen Anzahl von Defekten begleitet war, die an den Wachstumsgrenzen auftraten; jeder Defekt würde dazu führen, dass sich sein Zustand geringfügig von den umgebenden Wachstumsgrenzen unterscheidet (ein sehr kleiner Bereich); somit war der resultierende Ni-Nanokonus strikt ein N -seitige polygonale Pyramide, die als lokale Unordnung bezeichnet wurde. Obwohl es unterschiedliche Zustände (Wachstumsrate, Wachstumsrichtung usw.) zwischen zwei benachbarten Defekten gab, war dies im Vergleich zu diesen beiden weit auseinander liegenden Defektaggregationspunkten vernachlässigbar. Auf Makroebene wurden nur zwei Defektaggregationspunkte mit ausreichenden Statusunterschieden, die Aufmerksamkeit verdienten, und isolierte Defekte innerhalb bestimmter Statusbereiche „zusammengeführt“. was als globale Ordnung bezeichnet wurde (Abb. S1).
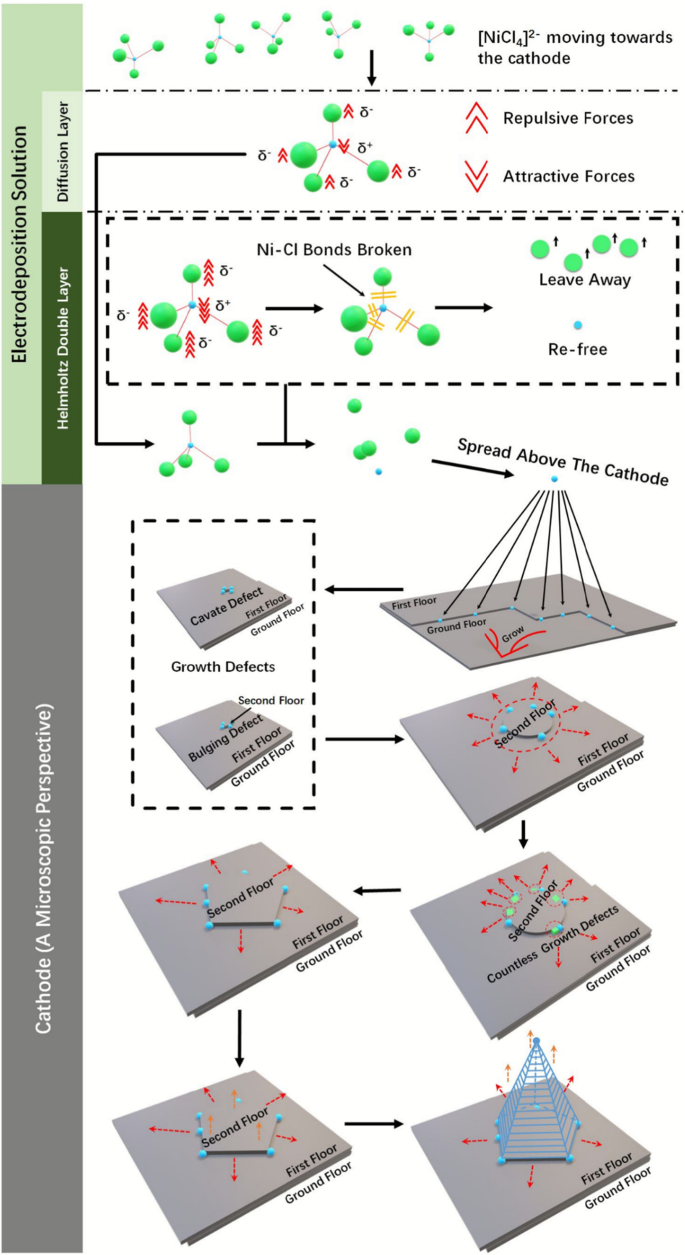
Mehrdimensionaler Wachstumsmechanismus globaler Ordnung und lokaler Unordnung:der Bruch von [NiCl4 ] 2− koordinieren kovalente Bindungen, den Bewegungszustand und den Anordnungsmodus von Ni 2+ auf der Kathode
Auswirkung von Komponenten
Um die spezifische Wirkung von Komponenten in der Lösung weiter zu untersuchen, wurden Kontrollvariaten verwendet, um eine vorläufige Analyse der Oberflächennanostruktur durchzuführen, die durch Elektroabscheidung bei verschiedenen Konzentrationen von NaCl, NiCl2 . erhalten wurde , und H3 BO3 , und ziehen Sie entsprechende Schlussfolgerungen.
Wirkung von NaCl
Abbildung 4 zeigt die REM-Aufnahmen mit niedriger und hoher Vergrößerung von Kathoden, die unter verschiedenen NaCl-Konzentrationen bei 0 g/l galvanisch abgeschieden wurden (Abbildung 4 a1 und a2 ), 100 g/L (Abb. 4 b1 und b2 ) und 167 g/L (Abb. 4c1 und c2 ), bzw. Wenn der Lösung kein NaCl zugesetzt wurde, war die Kathodenoberfläche mit blockigem Ni270 . bedeckt Nanostruktur (Abb. 4 a1 ), und obwohl einige Blöcke an der Spitze eine turmförmige Tendenz hatten (Abb. 4a2 ), es schien nur unentwickeltes Ni270 . genannt zu werden Nanokegel. Der Grund, warum es zu einer großen Anzahl von unentwickelten Ni-Nanokegeln auf der Oberfläche der Kathode führte, war, dass nur NiCl2 in der angegebenen Lösung Cl − , was zu weniger Cl − . machte um eine große Anzahl von [NiCl4 . herzustellen ] 2− , und behinderte darüber hinaus die Erzeugung von Ni270 . ernsthaft Nanokegel. Als die Konzentration von NaCl anstieg (100 g/L), konnte beobachtet werden, dass noch etwas unentwickeltes Ni370 . vorhanden war Nanokegel (Abb. 4 b1 ), aber an einigen Stellen ein ausgeprägterer Trend zu Ni-Nanokegeln (Abb. 4b2 ). Dies lag daran, dass die Zugabe von NaCl in der Lösung den Mangel an Cl − . stark verringerte , förderte die Bildung von [NiCl4 ] 2− , konnte aber immer noch kein Verhältnis von 1:4 erreichen (n(Ni 2+ ):n(Cl − )), und die Kathodenoberfläche war mit vielen unentwickelten Ni370 . bedeckt Nanokegel. Durch weitere Erhöhung der NaCl-Konzentration auf 167 g/L konnte festgestellt werden, dass der größte Teil der Kathodenoberfläche mit Ni437 . bedeckt war Nanokegel, die es fast unmöglich machten, unentwickeltes Ni437 . zu entdecken Nanokegel (Abb. 4 c1 , c2 ). Die große Menge an Cl − in der Lösung ermöglichte die Herstellung einer großen Menge von [NiCl4 ] 2− , das die Bildung von galvanisch abgeschiedenem Ni437 . stark förderte Nanokegel.

SEM-Bilder mit niedriger und hoher Vergrößerung von Kathoden, die bei verschiedenen NaCl-Konzentrationen galvanisch abgeschieden wurden:0 g/L (a 1 , a 2 ), 100 g/L (b 1 , b 2 ) und 167 g/l (c 1 , c 2 ) bzw.
Wirkung von NiCl2
Abbildung 5 zeigt die REM-Aufnahmen mit niedriger und hoher Vergrößerung von Kathoden, die unter verschiedenen NiCl2 . galvanisch abgeschieden wurden Konzentrationen:0 g/L (Abb. 5 a1 und a2 ), 200 g/L (Abb. 5 b1 und b2 ), 400 g/L (Abb. 5 c1 und c2 ), bzw. Aus Abb. 5 a1 wurde deutlich dass die Kathodenoberfläche von einer baumwollflockenförmigen Struktur bedeckt war und die gesamte Oberflächenstruktur dazu neigte, dichter mit Ni-Kugeln, aber ohne Kegelstruktur gestapelt zu sein (Abb. 5a2 ). Der Grund, warum Ni 2+ auf der Kathode langsam und durchschnittlich galvanisch abgeschieden und eine baumwollflockenförmige Struktur verursacht wurde, war, dass kein Ni 2+ . vorhanden war in der Lösung vor der Elektroabscheidung; Ni 2+ die für die galvanische Abscheidung erforderlich sind, stammten alle von den Ni-Atomen, die an der Anode Elektronen verloren, was zu einer niedrigen Konzentration von Ni 2+ . führte in der Lösung, also auch bei einer großen Anzahl von Cl − , die Erzeugung von [NiCl4 ] 2− war selten, was die Bildung der Ni-Nanokonenstruktur ernsthaft behinderte. Nach Erhöhung der Konzentration von NiCl2 in der Lösung auf 200 g/l war die galvanisch abgeschiedene Kathodenoberfläche mit etwas Ni370 . bedeckt Nanokegel und andere unentwickelte (Abb. 5 b1 ), die gesamte Oberfläche war rau und fragmentiert (Abb. 5b2 ). NiCl2 der Lösung zugesetzt, erhöhte die Bildung von [NiCl4 . erheblich ] 2− , führte zur Bildung von Ni370 Nanokegel, aber ein Teil von unterentwickeltem Ni370 Nanokegel deuteten darauf hin, dass die Konzentration möglicherweise nicht das optimale Niveau erreicht hatte. Wenn die Konzentration von NiCl2 400 g/L erreichte, war die Kathodenoberfläche mit einer großen Anzahl riesiger Ni570 . bedeckt Nanokegel (Abb. 5 c1 ). , rote Linien). Theoretisch ist die Konzentration von Ni 2+ bereitgestellt von NiCl2 (400 g/L) war viel höher als gewünscht, was stattdessen den Mangel an Cl − . hervorhob; dann eine große Anzahl von Ni 2+ galvanisch auf der Kathode während eines kurzen Zeitraums abgeschieden führte zu Ni570 Nanokegel wuchsen zu schnell, um die lokalen Unordnungsmerkmale darzustellen, aber entstanden eine Kegelstruktur.

REM-Aufnahmen mit niedriger und hoher Vergrößerung von Kathoden, die auf verschiedenen NiCl2 . galvanisch abgeschieden wurden Konzentrationen:0 g/L (a 1 , a 2 ), 200 g/L (b 1 , b 2 ) und 400 g/l (c 1 , c 2 ) bzw.
Auswirkung von H3 BO3
In der Versuchsreihe H3 BO3 war die Rolle des pH-Regulators, da Bor (B) ein elektronenarmes Atom war, konnte es sich mit Wasserstoff-Sauerstoff-Wurzelionen (OH − ) aus den Wassermolekülen und setzen dabei Wasserstoffionen (H + ) (Gl. 1).
$$ \mathrm{B}{\left(\mathrm{OH}\right)}_3+{\mathrm{H}}_2\mathrm{O}\to \mathrm{B}{\left(\mathrm{OH} \right)}_4^{-}+{\mathrm{H}}^{+} $$ (Gl. 1)Abbildung 6 zeigt die REM-Aufnahmen mit niedriger und hoher Vergrößerung von Kathoden, die von verschiedenen H3 . galvanisch abgeschieden wurden BO3 Konzentrationen:0 g/L (Abb. 6 a1 und a2 ), 25 g/L (Abb. 6 b1 und b2 ), 50 g/L ((Abb. 6c1 und c2 ), bzw. In Abb. 6a1 , war deutlich zu erkennen, dass die Kathode mit einer relativ flachen galvanischen Schicht bedeckt war und einige Bereiche leichte Vorsprünge aufwiesen (Abb. 6 a2 ), aber kein Ni320 Nanocones Struktur insgesamt. Als es kein H3 . gab BO3 in der Lösung würde in der Nähe der Kathode nur eine elektrolysierte Wasserreaktion stattfinden, daher befand sich die Lösung im Allgemeinen in einem Säure-Base-Gleichgewichtszustand und Ni 2+ waren fast immun gegen den Einfluss von OH − oder H + , was zu einer flachen Elektrotauchschicht führt. H3 hinzufügen BO3 bis 25 g/L in der Lösung konnten wir offensichtlich riesige Ni345 . beobachten Nanocones-Struktur aus Abb. 6 b1 , während der Texturtrend komplex war, waren die Kanten und Ecken klar (Abb. 6b2 ). Dies war auf die Zugabe von H3 . zurückzuführen BO3 , das mehr H + . lieferte in der Nähe der Kathode, was zu einer schwach sauren Umgebung führt. Wenn die Konzentration von H3 BO3 in der Lösung erreichte 50 g/L die Größe von Ni370 Nanokegel wurde im Vergleich zu Ni345 . reduziert Nanokegel, aber die Oberflächentextur war glatter. Dies lag an der großen Anzahl von H3 BO3 , wodurch die Lösung schwach sauer erschien (etwas saurer als die vorherige), das übermäßige H + beeinflusste die Größe von Ni370 Nanokegel, aber die Oberfläche gleichmäßiger gemacht.

REM-Aufnahmen mit niedriger und hoher Vergrößerung von Kathoden, die bei verschiedenen H3 . galvanisch abgeschieden wurden BO3 Konzentrationen:0 g/L (a 1 , a 2 ), 25 g/L (b 1 , b 2 ) und 50 g/l (c 1 , c 2 ) bzw.
Insgesamt war die Größe der Ni-Nanokegel nicht proportional zur Menge an H3 BO3 in der Lösung. Dies könnte der Fall sein, wenn die Lösung frei von H3 . war BO3 , das negativ geladene OH − stört die positive Elektrizität Ni 2+ , die die Bewegung von Ni 2+ . beeinflusste . Andererseits, wenn eine große Menge H3 BO3 wurde in der Lösung präsentiert, viel H + würde die Kathodenoberfläche anbringen, um Wasserstoff zu erzeugen (H2 ), aber aufgrund der geringen Größe von H + selbst war der Einfluss auf die Nanostruktur von Ni-Nanokegeln ziemlich begrenzt.
Schlussfolgerung
Zusammenfassend konnten wir erfolgreich Ni-Nanokonen durch Elektrotauchlackierung in einer Lösung mit NiCl2 . synthetisieren , NaCl und H3 BO3 . Die Ergebnisse haben gezeigt, dass das Zwischenprodukt ein spezieller Komplex war, der nach der Reaktion noch vorhanden war und eine schlechte Hochtemperaturbeständigkeit aufwies, und dass Ni-Nanokonen reines Ni mit fcc-Struktur waren, die hauptsächlich entlang der (220)-Kristallfläche gewachsen waren. Darüber hinaus wurde die spezifische Struktur des Zwischenprodukts durch bekannte ausgereifte theoretische Systeme gestützt, die Nanostruktur und der galvanische Abscheidungsprozess der Produkte untersucht und der wahrscheinliche Bildungsmechanismus von Ni-Nanokonen basierend auf den experimentellen Ergebnissen diskutiert. In der Zwischenzeit fanden wir heraus, dass die Nanostruktur von Ni-Nanokonen durch Anpassung der experimentellen Bedingungen wie der Konzentration von NiCl2 . gesteuert werden kann , NaCl und H3 BO3 , bzw. Daher war die Festlegung geeigneter Parameter der Schlüsselpunkt für die Synthese von Ni-Kristallen mit Nanokegelstruktur über diesen Elektroabscheidungsansatz. Darüber hinaus erwarteten wir, dass diese neuartige Strategie möglicherweise auf einige andere magnetische Metalle ausgeweitet werden könnte, um eine kontrollierbare Nanokonusstruktur zu synthetisieren.
Verfügbarkeit von Daten und Materialien
Die zur Unterstützung der Schlussfolgerung verwendeten Datensätze sind im Artikel und in der unterstützenden Datei enthalten.
Nanomaterialien
- Die Pentode
- Butter und Margarine
- 3D-Druck – Was Sie jetzt und in Zukunft erstellen können
- Weiterbildung und Führung in der Technologiebranche als 40-jährige Frau
- Enthüllung der atomaren und elektronischen Struktur von gestapelten Kohlenstoff-Nanofasern
- Was mir die Marine über das Management von Lieferketten und Logistik beigebracht hat
- Wie Timing und Glück den Produktfluss für Ricoma während der Pandemie gewährleisteten
- Gehackte Kohlefaser, Polyamid und Innovation definieren die moderne Ladefläche eines Pickups neu
- EMO 2017 und der Aufstieg unsichtbarer Innovationen
- COMPAX:Das perfekte Paket aus Effizienz, Qualität und Einsparungen



