PD-L1 monoklonale Antikörper-dekorierte Nanoliposomen, beladen mit Paclitaxel und P-gp-Transporthemmer für die synergistische Chemotherapie gegen multiresistente Magenkrebse
Zusammenfassung
Multidrug Resistance (MDR) basierend auf ATP-abhängigen Efflux-Transportern (p-Glykoprotein (p-gp)) bleibt ein Haupthindernis für eine erfolgreiche Chemotherapie. Hier haben wir das Potenzial von PD-L1-mAb-konjugierten Nanoliposomen als zielgerichtete Abgabeplattform für die gemeinsame Abgabe von Paclitaxel (PTX) und p-gp-spezifischem Transporthemmer (TQD, Tariquidar) bei arzneimittelresistenten Magenkarzinomen untersucht . Zwei Medikamente, PTX und TQD, wurden gemeinsam in einem einzigen Vehikel in einem genauen Verhältnis beladen, um die Aussicht auf eine chemotherapeutische Kombinationswirkung zu erhöhen. Eine zelluläre Aufnahmestudie zeigte, dass PD-PTLP eine höhere Internalisierungseffizienz in PD-L1-Rezeptor-überexprimierenden SGC7901/ADR-Zellen aufwies als nicht zielgerichtetes PTLP. Die höchste Synergie wurde bei einem Gewichtsanteil von 1/0,5 (PTX/TQD) beobachtet und die Kombination von PTX und TQD führte zu einer offensichtlichen synergistischen Wirkung im Vergleich zu der einzelner Medikamente allein. Unsere In-vitro-Ergebnisse zeigten, dass TQD die Mehrfachresistenz von SGC7901/ADR-Zellen wirksam umkehrte. Der IC50-Wert von PD-PTLP betrug 0,76 µg/ml im Vergleich zu 6,58 µg/ml und 7,64 µg/ml für PTX bzw. TQD. PD-TPLP löste im Vergleich zu freiem PTX oder TQD signifikant höhere Spiegel an reaktiven Sauerstoffspezies (ROS) und Zellapoptose aus. Darüber hinaus zeigte die In-vivo-Antitumorstudie, dass die Kombinationschemotherapie von PD-PTLP eine signifikante Hemmung der Tumorlast von arzneimittelresistenten Xenotransplantat-Tumoren mit signifikant höheren terminalen Desoxynukleotidyltransferase-dUTP-Nick-End-Labeling (TUNEL)-positiven Zellen zeigte. Darüber hinaus führte freies PTX zu einem signifikanten Anstieg der AST- und ALT-Spiegel, während sich PD-PTLP unwesentlich von der Kontrolle unterschied, die den Sicherheitsindex anzeigt. Insgesamt glauben wir, dass die Kombination eines Krebsmedikaments mit einem p-gp-Inhibitor eine potenzielle Richtung für die Behandlung von arzneimittelresistenten Magentumoren sein könnte.
Einführung
Die heutigen chemotherapeutischen Behandlungen, die auf einem Einzelmedikamentenregime basieren, sind bei weitem nicht perfekt und leiden bei höheren Dosierungen unter schweren Nebenwirkungen und führen gleichzeitig zur Entwicklung von Arzneimittelresistenzen [1]. In den letzten zehn Jahren wurde die hohe therapeutische Wirksamkeit von Kombinationspräparaten bei der Krebsbehandlung beobachtet [2]. Es wurde gezeigt, dass die Kombination von zwei oder mehr Medikamenten aufgrund der unterschiedlichen pharmakologischen Wirkung von Kombinationsmedikamenten eine synergistische Antikrebswirkung ergibt [3, 4]. Die Auswahl der richtigen Medikamentenkombination hängt jedoch von mehreren Faktoren ab, darunter Krebszelltyp, hydrophile/hydrophobe Medikamente, biochemische Aktivitäten und pharmakokinetische Muster der Medikamente. Unter allen ist die Kombination von Medikamenten für bestimmte Krebsarten selektiv [5].
Magenkrebs ist eine globale Gesundheitsbelastung und die zweithäufigste krebsbedingte Todesursache weltweit. Die Prävalenz von Magenkrebs ist in Ostasien wie Japan, Korea und China hoch, wobei letztere die höchste Sterblichkeitsrate der Welt melden [6]. Im Durchschnitt werden in China jedes Jahr 400.000 neue Fälle registriert und die meisten Fälle werden in fortgeschrittenen/späteren Stadien diagnostiziert [7, 8]. Bei den Behandlungsstrategien wurden enorme Fortschritte erzielt; es verbesserte jedoch nicht die Überlebensrate und führte zu einem Therapieversagen. Das Versagen der Behandlung wurde hauptsächlich auf die Entwicklung einer Chemoresistenz und eine schwere Toxizität der Chemotherapiedosis und das Wiederauftreten einer Magenkrebsepisode zurückgeführt [9]. Daher besteht eine dringende Aufgabe, die therapeutische Wirksamkeit zu verbessern und die Metastasierung und das Wiederauftreten von Magenkrebs zu überwinden.
Paclitaxel (PTX) ist eines der wichtigsten Medikamente zur Behandlung von Magenkrebs [10]. PTX hemmt die Zellreplikation, indem es den Abbau von Mikrotubuli stört und dadurch zum Stillstand des Zellzyklus führt. Der Erwerb einer Multidrug-Resistenz (MDR) ist jedoch ein großes Hindernis für den Erfolg einer Chemotherapie [11, 12]. Der ATP-abhängige Efflux, der durch Transmembrantransporter der ATP-Bindungskassetten (ABC)-Familie vermittelt wird, in denen p-Glykoprotein (p-gp) als der wohlhabende Faktor gilt, wird bei Magenkrebs überexprimiert [13]. Umgekehrt dient PTX als Substrat für p-gp-Rezeptoren, wobei der Arzneimittelausfluss die intrazelluläre Arzneimittelkonzentration reduziert, was zu geringer Wirksamkeit und hoher Resistenz führt [14]. In dieser Hinsicht ist Tariquidar (TQD) ein potenter p-gp-Inhibitor der dritten Generation und soll die Überexpression von p-gp-Rezeptoren in mehreren Krebszellen rückgängig machen [15, 16]. Berichte legten jedoch nahe, dass die TQD-Verabreichung frühzeitig beendet werden muss, da sie die p-gp-Funktion des normalen physiologischen Systems behindert. Die Expression von P-gp ist erforderlich, um die Blut-Hirn-Schranke (BBB) aufrechtzuerhalten und Toxine aus dem normalen Gewebe zu entfernen [17]. Da p-gp in normalen Geweben vorhanden ist und als Barriere gegen zelluläre Toxine wirkt, könnte eine unspezifische Hemmung von PTX oder TQD potenziell die normalen physiologischen Funktionen stören und zu einer nachteiligen Toxizität führen. Außerdem sind PTX und TQD stark lipophile Medikamente mit begrenzter Löslichkeit in wässrigen Lösungen und systemischem Blut, was die Notwendigkeit eines stabilen Medikamentenabgabesystems erfordert, das auf Magenkrebs im Körper ausgerichtet ist [18].
Das Drug-Delivery-System (DDS) erhöhte die Konzentration der verkapselten Wirkstoffe im Krebsgewebe signifikant und bot eine anhaltende Wirkstofffreisetzung über einen längeren Zeitraum [19]. In dieser Hinsicht ist das Liposom einer der weit verbreiteten Arzneimittelträger, um die therapeutische Wirksamkeit bei Krebserkrankungen zu verbessern. Liposomen gewannen aufgrund ihrer Biokompatibilität, strukturellen Oberflächenmodifikationen, hydrophiler/lipophiler Wirkstoffbeladung und hoher Wirkstoffbeladungskapazität zunehmend an Bedeutung [20]. Die Medikamente könnten stabil in die Lipid-Doppelschicht von Liposomen eingebaut werden und leicht eine lange Zirkulationsfähigkeit (PEGylierung) durch einen verbesserten Permeations- und Retentionseffekt (EPR) verleihen [21]. Kürzlich wurde von Liposomen die Fähigkeit berichtet, die multiplen Wirkstoffverhältnisse nach intravenöser Verabreichung beizubehalten [22]. Diese Idee wurde 2017 nach der Zulassung durch die FDA von Vyxeos® (liposomale Formulierung) mit Verhältnissen von Cytarabin:Daunorubicin zur Behandlung von Leukämie demonstriert [23]. Im Vergleich zu nicht zielgerichteten Formulierungen waren auf Liganden gerichtete Formulierungen sehr attraktiv und zukunftsträchtig. In dieser Hinsicht ist PD-1 ein Zelloberflächenrezeptor, der für die Herunterregulierung des Immunsystems bekannt ist und die entzündliche Aktivität von T-Zellen unterdrückt. Die PD-L1-Expression wurde bei 50 % der Magenkrebspatienten berichtet, die PD-L1 als Zielrezeptor für die Internalisierung von Nanopartikeln verwenden [24, 25]. Der monoklonale Antikörper (mAb) PD-L1 könnte spezifisch an die extrazelluläre Domäne des PD-L1-Proteins binden und könnte eine ausgezeichnete therapeutische Strategie zur Verbesserung der Antikrebswirksamkeit sein [26].
Das Hauptziel der vorliegenden Studie war es, die Verabreichung von Kombinationsmedikamenten, PTX und TQD, zu verbessern, um die krebshemmende Wirkung gegen Magenkrebs zu verbessern. Zu diesem Zweck wurde ein mit PTX und TQD beladenes PD-L1/Nanoliposom formuliert und auf seine Antikrebswirksamkeit unter in vitro- und in vivo-Bedingungen untersucht. Die In-vivo-Wirksamkeit wurde in einem Xenotransplantat-Modell auf der Grundlage von Magenkrebszellen bewertet und eine Immunhistochemie (IHC) wurde durchgeführt.
Schlussfolgerung
Zusammenfassend wurde in unserer Arbeit eine Kombinationstherapie gegen MDR-Tumoren durch eine programmierte Abgabestrategie realisiert. Wir haben das Potenzial der Kombination von PTX und p-gp-Inhibitor (TQD) bei der Hemmung der Tumorlast von multiresistenten SGC7901/ADR-Xenotransplantat-Tumoren nachgewiesen. Die gemeinsame Abgabe von PTX und TQD in einem multifunktionalen Nanoträger ermöglichte die ratiometrische Kontrolle von gemeinsam beladenen Krebsmedikamenten, hemmte die p-gp-Effluxpumpe und zeigte die synergistische Antikrebswirkung. Wir glauben, dass die Kombination eines Krebsmedikaments mit einem p-gp-Inhibitor eine potenzielle Richtung zur Behandlung von arzneimittelresistenten Tumoren bieten könnte.
Materialien und Methoden
Formulierung von PD-L1-mAb-konjugierten PTX/TQD-beladenen Nanoliposomen
Das Ei-Phosphatidylcholin (EPC), 1,2-Dioleoyl-sn-glycero-3-phosphoethanolamin (DOPE), 1,2-Distearoyl-sn-glycero-3-phosphoethanolamin-N-[methoxy(polyethylenglykol)-2000] ( DSPE-PEG) und DSPE-PEG2000-Maleimid (DSPE-PEG2000-Mal) gemischt in einer Chloroformlösung in einem Molverhältnis von 3/2/0,5/0,25 zusammen mit PTX und TQD und dann wurde das organische Lösungsmittel unter Verwendung eines Rotationsverdampfers verdampft gefolgt von Gefriertrocknung für 3 h. Der Lipidfilm wurde mit einer 250 mM Ammoniumsulfatlösung hydratisiert, die bei pH 7,0 gehalten wurde. Die großen multilamellaren Liposomen wurden 30 min lang in einem Beschallungsgerät vom Badtyp (Branson Ultraschallbad, USA), das bei 65 °C gehalten wurde, beschallt. Die Liposomen wurden streng 1 h lang gegen ein großes Volumen destillierten Wassers dialysiert, um das freie Arzneimittel und die anfänglichen Komponenten auszutauschen. Die Liposomen wurden in einer phosphatgepufferten Kochsalzlösung (PBS, pH 7,4) redispergiert. Der PD-L1-mAb wurde durch Mischen im Verhältnis 8:1 (Liposom:mAb) an das Liposom konjugiert und 4 h bei 4 °C inkubiert. Der PD-L1-mAb wird an DSPE-PEG2000-Mal durch Wechselwirkung zwischen Sulfhydrylresten auf den Antikörpern gegen die C-terminalen Maleinimidgruppen von Liposomen konjugiert. Die PD-L1-konjugierten Liposomen wurden 10 min bei 10.000 UpM zentrifugiert und der Überstand wurde entfernt und in einem PBS-Puffer redispergiert und bis zur weiteren Analyse bei 4 °C gelagert. Die im Liposom eingekapselte Menge an PTX und TQD wurde durch das HPLC-Verfahren bewertet. In der Studie wurde das HPLC-System Modell 1260 Infinity von Agilent Technologies verwendet, das mit einem Autosampler von Agilent Technologies und einem G1315D-Diodenarray-Detektor ausgestattet ist. Die mobile Phase besteht aus einer Mischung aus Acetonitril/Wasser (70:30 v/v), die bei einer Flussrate von 1 ml/min gehalten wird. Zur Elution der Proben wurde eine C18-Säule (5 µm, 150 × 60 mm, ODS-3) verwendet und bei 227 nm detektiert. Zuvor wurde das mit PTX/TQD beladene Liposom in Acetonitril gelöst und für 15 Minuten gevortext, durch einen 0,45-μm-Filter filtriert und 10 μl des Aliquots wurden in die HPLC-Säule injiziert.
Größenverteilung und Partikelmorphologieanalyse
Die Größenverteilung und das Zetapotential von arzneimittelbeladenen Formulierungen wurden mit Malvern Zetasizer (UK) bei 25 °C bestimmt. Vor dem eigentlichen Versuch wurden Nanopartikel-Dispersionen mit dem destillierten Wasser 10x verdünnt und der Versuch bei einem Detektionswinkel von 90° dreifach durchgeführt. Die Morphologie der Nanopartikel wurde mittels Transmissionselektronenmikroskop (TEM) bewertet. Die Nanopartikel-Dispersionen wurden 10x mit destilliertem Wasser verdünnt und in ein kohlenstoffbeschichtetes Kupfergitter gegeben und mit einer IR-Lampe getrocknet und dann wurde die Probe nach Anfärben mit Uranylacetat durch TEM (CM 30, Philips (Eindhoven, Niederlande)) bewertet (1% Gew./Vol.).
Profilanalyse veröffentlichen
Das Freisetzungsprofil von PTX und TQD aus Nanoliposomen wurde durch das Dialyseverfahren bewertet. Dazu wurden 15 mg lyophilisiertes Pulver aus PD-L1 mAb-konjugiertem PTX und TQD-beladenen Nanoliposomen (PD-PTLP) in 1 ml destilliertem Wasser gelöst und in einer Dialysemembran (MWCO 3,5 kDa) versiegelt und in ein a 30 ml des jeweiligen Freisetzungspuffers, gehalten bei 37 °C. Zu einem vorbestimmten Zeitpunkt wurden Aliquots von Proben entnommen und durch die gleiche Menge an Freisetzungspuffer ersetzt. Die Studie wurde 72 h fortgesetzt. Die Proben wurden durch 0,22 µm Spritzenfilter filtriert und in die HPLC-Säule injiziert und nach der oben genannten Methode ausgewertet.
Studien zur zellulären Aufnahme
SGC7901/ADR-Zellen wurden in Dulbeccos modifiziertem Eagle-Medium (DMEM), ergänzt mit 10 % FBS und 100 IE/ml Penicillin und 100 µg/ml Streptomycin, unter der Bedingung von 5 % CO2 . kultiviert Atmosphäre bei 37 °C. Ein konfokales Laser-Scanning-Mikroskop (BX61WI; Olympus, Tokio, Japan) wurde verwendet, um die zelluläre Verteilung und die zelluläre Aufnahme von PTLP und PD-PTLP in SGC7901/ADR-Zellen zu bewerten. Um diesen Zweck zu erreichen, 1 × 10 5 Zellen wurden in jede Vertiefung einer 12-Well-Platte ausgesät und für 18 h inkubiert. Die Zellen wurden dann mit PTLP und PD-PTLP exponiert und für 3 h inkubiert. Die Zellen wurden dreimal mit kaltem PBS gewaschen und mit 4% Paraformaldehyd (PFA) für 10 min fixiert. Die Zellen wurden erneut mit PBS gewaschen und mit 4,6-Diamidino-2-phenylindol (DAPI) für 10 min gefärbt. Schließlich wurden die Zellen sorgfältig gewaschen und unter CLSM beobachtet. Das kompetitive Experiment zur Aufnahme von PD-PTLP wurde durchgeführt, indem die Zellen 30 min mit freiem PD-L1-mAb vorbehandelt und gewaschen wurden. Die Zellen wurden in zwei Gruppen eingeteilt, eine mit freiem PD-L1-mAb behandelt und die andere nicht mit freiem PD-L1-mAb behandelt. Die Zellen wurden mit PD-PTLP inkubiert und für 3 h inkubiert und dasselbe Verfahren wurde für die Auswertung der zellulären Aufnahmeanalyse befolgt.
Proteinexpression durch Western-Blot-Assay
Die SGC7901/ADR-Zellen wurden in einer 6-Well-Platte mit einer Aussaatdichte von 3 × 10 5 . ausgesät Zellen/Vertiefung und für 18 h inkubiert. Die Zellen wurden mit unterschiedlichen Formulierungen (PTX, TQD, PTLP, PD-PTLP) behandelt und 24 h inkubiert. Die Zellen wurden gewaschen und mit Stripping-Puffer extrahiert und unter Verwendung eines Standard-Lysepuffers (Santa Cruz Biotechnology, Santa Cruz, CA, USA) lysiert. Die Zellen wurden bei einer Geschwindigkeit von 12.000 U/min für 15 min zentrifugiert und der Überstand wurde gesammelt und die Proteinquantifizierung wurde unter Verwendung des BCA-Proteinassays (Beyotime) durchgeführt. Eine gleiche Menge an Proteinen wurde in ein 8% SDS-PAGE-Gel geladen und dann auf eine Nitrozellulosemembran (EMD Millipore, Billerica, MA, USA) übertragen. Die Membran wurde 1 h mit 5% Magermilch blockiert, um die unspezifischen Bindungsstellen zu hemmen. Die Membran wurde mit primären Antikörpern (p-gp und GAPDH, 1:1000, Abcam, MA, USA) über Nacht bei 4 °C inkubiert. Die Membran wurde mit TBST gewaschen und erneut mit sekundären Antikörpern von Meerrettichperoxidase-markierten Ziegen-Anti-Kaninchen- oder -Maus-Antikörpern (Kaninchen oder Maus, 1:10.000, Abcam, MA, USA) bei Raumtemperatur inkubiert. Die Membranen wurden erneut mit TBST gewaschen. Die Blots wurden mit einer verstärkten Chemilumineszenz-Methode (EMD Millipore) visualisiert.
In-vitro-Zytotoxizitätsanalyse
Die zytotoxische Wirkung einzelner Arzneimittel und Formulierungen wurde durch den MTT-Assay bewertet. Kurz gesagt, Krebszellen wurden mit einer Dichte von 1 × 10 4 . geschichtet Zellen/Well in einer 96-Well-Platte und 18 h inkubiert. Die Zellen wurden dann 24 h lang mit freiem PTX, TQD, PTLP bzw. PD-PTLP behandelt. Als nächstes wurden die Zellen sorgfältig gewaschen und mit 15 &mgr;l 5 mg/ml MTT-Lösung versetzt und 3 h zusätzlich inkubiert und dann wurden 100 &mgr;l DMSO zugegeben, um die Formazankristalle zu extrahieren. Die resultierende Extinktion wurde bei 570 nm unter Verwendung eines automatisierten Mikroplatten-Lesegeräts gemessen. Die Lebensfähigkeit der Zellen wird berechnet durch OD der Testgruppe/OD der Kontrolle × 100%. Der Kombinationsindex wurde von Calcusyn TM . ausgewertet Software. Alle Experimente wurden in dreifacher Ausführung durchgeführt.
In-vitro-Analyse von Apoptose und reaktiven Sauerstoffspezies
Für den Apoptose-Assay wurden Krebszellen mit einer Dichte von 2 × 10 5 . geschichtet Zellen/Well in einer 12-Well-Platte und 18 h inkubiert. Die Zellen wurden dann 24 h lang mit freiem PTX, TQD, PTLP bzw. PD-PTLP behandelt. Die Zellen wurden durch Strippen extrahiert und zentrifugiert und die Pellets wurden in 100 µl Bindungspuffer redispergiert. Die Zellen wurden mit einer Kombination aus 5 µl Annexin-V/FITC und 2,5 µl PI-Arbeitslösung co-gefärbt und 15 min inkubiert. Die gefärbten Zellen wurden mit einem Durchflusszytometer unter Verwendung eines BD FACS Calibur (BD Biosciences, CA, USA) analysiert. Annexin-V und PI repräsentieren den frühen Apoptose-Indikator und den späten Apoptose-Indikator basierend auf den strukturellen Komponenten von lebenden bzw. toten Zellen.
Das 2,7-Dichlorfluorescindiacetat (DCFH-DA) wurde als Sonde für die Analyse der reaktiven Sauerstoffspezies (ROS) verwendet. Für quantitative Analysen 1 × 10 4 Zellen/Well wurden in eine 96-Well-Platte mit schwarzem Boden ausgesät und für 18 h inkubiert. Die Zellen wurden dann 24 h lang mit freiem PTX, TQD, PTLP bzw. PD-PTLP behandelt. Die Zellen wurden mit PBS-Puffer gewaschen und anschließend mit 1 ml DCFH-DA-Lösung gemäß Herstellervorschrift für 30 min inkubiert. Gefolgt von Zellen, die lysiert und bei 10.000 U/min für 15 Minuten zentrifugiert wurden. Der resultierende Überstand wurde auf eine neue 96-Well-Platte überführt und die Fluoreszenz wurde bei 485 nm unter Verwendung eines automatisierten Mikroplatten-Lesegeräts gemessen. Gleichzeitig wurde ein separater Satz von Zellen auf ähnliche Weise verarbeitet und die Bilder wurden unter Verwendung eines Fluoreszenzmikroskops (Nikon A1, Japan) betrachtet.
Antitumorwirksamkeit von PD-PTLP im Xenotransplantatmodell
Die Antitumor-Wirksamkeitsstudie wurde an BALB/c-Nacktmäusen durchgeführt und wurde vom Laboratory Animal Center, The Fourth Affiliated Hospital der Harbin Medical University, Harbin, erhalten. Alle Tierversuche wurden nach den nationalen Standards für Labortierqualität durchgeführt. Die Experimente wurden streng in Übereinstimmung mit den Richtlinien des Regulations for Experimental Animals Committee des Fourth Affiliated Hospital der Harbin Medical University, Harbin, durchgeführt. Den Tieren wurde 1 × 10 6 . subkutan injiziert SGC7901/ADR-Zellen in 150 µl Kulturmedium in der rechten Flanke der Mäuse. Die Tumoren durften bis 100 mm 3 . wachsen vor dem eigentlichen Experiment. Die Mäuse wurden gleichmäßig in fünf Gruppen mit acht Mäusen in jeder Gruppe eingeteilt. Die Einzeldosis von PTX und TQD wurde auf 5 mg/kg festgelegt, während die Kombination eine Gesamtdosis von 5 mg/kg verwendete. Die Schwanzveneninjektion erfolgte jeden dritten Tag, insgesamt wurden drei Injektionen durchgeführt. An vorbestimmten Tagen wurden Tumorvolumen und Körpergewicht gemessen. Das Tumorvolumen wurde berechnet, indem der längste Durchmesser und der kürzeste Durchmesser der Tumoren mit einem digitalen Messschieber gemessen wurden. Tumorvolumen (V ) =½ × Länge × Breite (mm) 2 . Die Mäuse wurden am Ende der Studie getötet und der Tumor wurde extrahiert und gewogen. Der Tumor wurde einer immunhistochemischen (IHC) Analyse unterzogen. Die Tumoren wurden extrahiert, in dünne Stücke geschnitten und in 10 % Formalinlösung fixiert. Die Tumoren wurden in ein Paraffinwachs eingebettet und anschließend der TUNEL-Test gemäß den Richtlinien des Herstellers durchgeführt.
Biochemische Serumanalyse
Den Mäusen wurden entsprechende Formulierungen verabreicht; 24 h später wurden die Mäuse getötet und Blutproben wurden von den Kontroll- und Test-behandelten Tiergruppen gesammelt. Das Serum wird vom Vollblut getrennt und bis zur weiteren Analyse bei − 80 °C gelagert. Eine biochemische Serumanalyse wurde durchgeführt, um die Leistung der Leber zu beurteilen. Zur Beurteilung der Leberfunktion wurden Aspartattransaminase (AST) und Alanintransaminase (ALT) gemessen. Alle Messungen wurden gemäß den Verfahren des biochemischen Kit-Assays durchgeführt.
Ergebnisse und Diskussion
Herstellung und Charakterisierung von PTX/TQD-beladenen PD-L1-konjugierten Nanoliposomen
Der PTX ist in Kliniken weit verbreitet und in erster Linie bei der Behandlung von Magenkrebs indiziert. Die Mehrheit der Patienten leidet jedoch offensichtlich unter einem schlechten therapeutischen Ansprechen aufgrund der Multidrug-Resistenz (MDR) des Magenkrebses. Eine Erhöhung der PTX-Dosis führte zu einer erhöhten systemischen Toxizität, wodurch MDR zu einem Haupthindernis bei der erfolgreichen Krebstherapie wurde. Unter einer Vielzahl von MDR-Mechanismen wird der p-gp-vermittelte Medikamenten-Efflux als primär verantwortlich für die Medikamentenresistenz in Krebszellen angesehen [27]. Daher haben wir in dieser Studie ein zweites Medikament (TQD) als p-gp-Inhibitor verwendet, um das MDR-Phänomen in den Krebszellen zu überwinden und die Antikrebswirksamkeit von PTX zu verbessern. Wir haben den Gewichtsanteil von zwei Arzneimitteln, in denen sie die synergistische Wirkung zeigen, sorgfältig untersucht. Um die Antikrebswirkung zu maximieren, ist es wichtig, die mehreren Medikamente in einem einzigen Nanopartikelsystem gemeinsam abzugeben. Die gleichzeitige Abgabe von zwei Medikamenten (PTX und p-gp-Inhibitor) ermöglicht die effiziente Unterdrückung des Medikamenten-Efflux-Mechanismus und erhöht die Aussicht auf erhöhte intrazelluläre Konzentrationen in den Krebszellen [28]. Zu diesem Zweck haben wir in dieser Studie zwei Wirkstoffe in die Lipiddoppelschicht von Nanoliposomen geladen, die in den systemischen Kreisläufen als äußerst stabil gelten (Abb. 1). Um das verbesserte tumorspezifische Targeting zu erreichen, wurden Nanoliposomen mit PD-L1-mAb oberflächenkonjugiert. Die im Nanoliposom vorhandene Maleimidgruppe bindet an die Thiolgruppe des PD-L1-mAb und bildet eine stabile kovalente Bindung. Eine mögliche Einschränkung der Maleinimid-Konjugation besteht jedoch darin, dass die Reaktion reversibel ist:Das Produkt könnte Retro-Michael-Additionsreaktionen mit biologischen Thiolen im Plasma eingehen, die zur Freisetzung des Maleinimids führen können. Wir haben jedoch eine solche Reaktion durch maximale Oberflächenkonjugation des Antikörpers an das Maleinimid-Liposom überwunden. Es wurde berichtet, dass ein auf Tumor abzielender Ligand spezifisch die therapeutische Belastung in den Tumorgeweben abgibt und unnötige Nebenwirkungen in den normalen Geweben vermeidet. Patel et al. berichteten, dass die Inkorporation von p-gp-Inhibitor mit PTX die MDR in der Eierstockkrebszelle unter In-vitro-Bedingungen überwinden könnte [11]. In ähnlicher Weise haben Zou et al. und Zhanget al. berichteten, dass die Zytotoxizität von PTX gegenüber multiresistenten Zellen von SKOV-3TR und A2780-Adr in Gegenwart von Tariquidar signifikant zunahm. In diesen Studien wurde jedoch entweder eine physikalische Kombination von PTX + TQD verwendet oder ein nicht zielgerichteter Träger entwickelt [29, 30]. Wichtig ist, dass alle diese Studien nur unter In-vitro-Bedingungen durchgeführt wurden. Die vorliegende Studie konzentrierte sich auf das Design des zielgerichteten Nanoträgers unter Verwendung einer relativ neuen Klasse von zielgerichteten Wirkstoffen, dem PDL1-Antikörper. Außerdem zeigte die vorliegende Studie die Wirksamkeit von PTX + TQD im Xenotransplantat-Tumormodell und bewertete auch die Blutparameter in Bezug auf die systemische Toxizität.
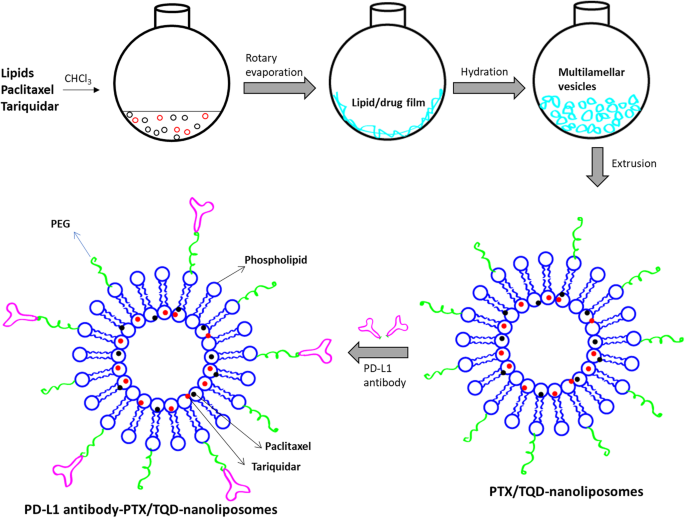
Schematische Darstellungen der Beladung mit Paclitaxel und Tariquidar in monoklonalen PD-L1-Antikörper (mAb)-Oberflächen-konjugierten Nanoliposomen. Das Liposom wurde durch Hydratation eines dünnen Lipidfilms hergestellt und beschallt, um die arzneistoffbeladenen Nanoliposomen zu bilden
Die durchschnittliche Partikelgröße von PTLP betrug 135,6 ± 1,26 nm, während sie nach Konjugation mit PD-L1-mAb (PD-PTLP) auf 168,59 ± 1,34 nm anstieg. Die Partikelgröße nahm aufgrund des großen Molekulargewichts des PD-L1-mAb zu; dennoch war eine Gesamtgröße von weniger als 200 nm und eine Kugelform der erwähnenswerte Punkt (Abb. 2a). Nanopartikel mit einer Größe von weniger als 200 nm ermöglichen eine höhere Akkumulation in Tumorgeweben aufgrund des verstärkten Permeations- und Retentionseffekts (EPR). Außerdem ermöglicht das Vorhandensein von PEG eine verlängerte Blutzirkulationszeit im systemischen Kreislauf. Das Zetapotential von PD-PTLP betrug 22,1 ± 1,21 mV, was keine unspezifische Bindung an die Blutkomponenten erlaubt. PD-PTLP zeigte für beide Medikamente (PTX und TQD) eine hohe Einschlusseffizienz von ~ 95%. PD-PTLP zeigte auch eine hohe Wirkstoffbeladung von 12–14 % w/w für PTX bzw. TQD (Abb. 2b).
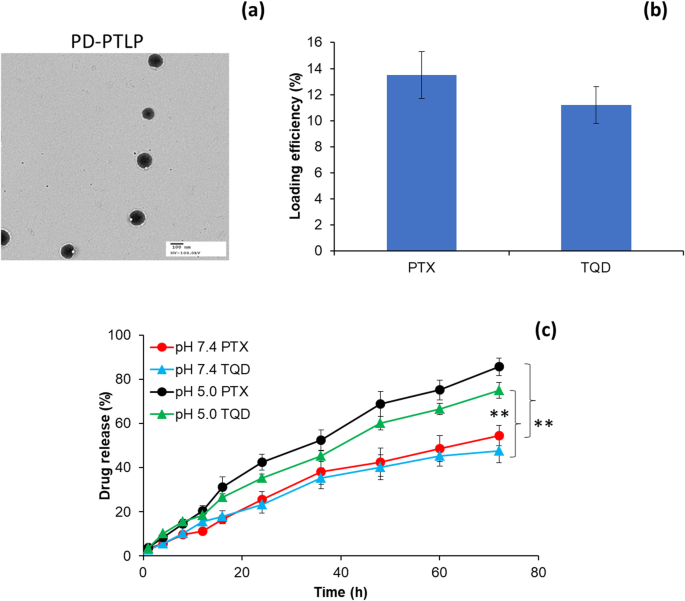
Physikochemische Charakterisierung von PTX/TQD-beladenen PD-L1-konjugierten Nanoliposomen. a Morphologieanalyse von PD-PTLP unter Verwendung eines Transmissionselektronenmikroskops (TEM). b Wirkstoffbeladungskapazität von PD-PTLP. c In-vitro-Freisetzung von PTX und TQD aus PD-PTLP bei pH 7,4 Puffer und pH 5,0 Pufferbedingungen bei 37 °C. **p <0,01 ist der statistische Unterschied in der Wirkstofffreisetzung zwischen pH 7,4 und pH 5,0 Puffern
In-vitro-Wirkstofffreisetzung
Das Freisetzungsverhalten von PTX und TQD aus PD-PTLP wurde unter pH 7,4 und pH 5,0 Bedingungen bei 37 °C untersucht. Wie in Abb. 2c gezeigt, wurde während des gesamten Studienzeitraums (72 h) eine kontrollierte Freisetzung von Arzneimitteln (PTX und TQD) aus dem PD-PTLP beobachtet. Die Freisetzung des Wirkstoffs aus der dicken Doppelschicht des Nanoliposoms könnte für die langsame und anhaltende Freisetzung von zwei Wirkstoffen aus dem PD-PTLP verantwortlich sein. Es muss angemerkt werden, dass kein signifikanter Unterschied im Freisetzungsmuster von PTX und TQD bei pH 7,4 und pH 5,0 beobachtet wurde. Zu einem längeren Zeitpunkt wurde ein signifikanter Unterschied in der Freisetzung bei verschiedenen pH-Bedingungen beobachtet. Es ist erwähnenswert, dass dem Nanoliposom keine pH-responsiven Elemente hinzugefügt wurden und eine höhere Wirkstofffreisetzung unter sauren Bedingungen der höheren Diffusion bei niedrigerem pH zugeschrieben werden könnte. Zum Beispiel werden ~ 85% des PTX unter pH 5,0-Bedingungen freigesetzt, verglichen mit ~ 55% der Wirkstofffreisetzung bei einer physiologischen pH-Umgebung. Ein ähnliches Muster der schnellen Freisetzung kleiner Moleküle bei sauren Bedingungen und einer langsameren Freisetzung bei basischen pH-Bedingungen wurde von anderen Forschern gezeigt. Dennoch könnte eine relativ niedrige Wirkstofffreisetzung bei pH 7,4 die unnötigen systemischen Nebenwirkungen reduzieren und den systemischen Kreislauf verlängern, während eine höhere Wirkstofffreisetzung bei pH 5,0 der höheren therapeutischen Wirksamkeit im Tumorgewebe zugute kommen könnte.
In-vitro-Analyse der zellulären Aufnahme
Die Abgabeeffizienz von zielgerichteten (PD-PTLP) und nicht zielgerichteten (PTLP) Nanoliposomen wurde in SGC7901/ADR getestet. Die zelluläre Aufnahme wurde unter Verwendung von Rhodamin-B als Fluoreszenz-Tracker bewertet. Rhodamin-B ist das am häufigsten verwendete Fluorophor ohne zellbiologische Wechselwirkungen. Der Kern wurde mit blau gefärbtem DAPI gefärbt und die rote Farbe stammte von den Nanopartikeln. Die CLSM-Daten zeigen deutlich, dass PD-PTLP im Vergleich zu nicht zielgerichtetem PTLP eine starke rote Fluoreszenz in den Krebszellen aufwies. Eine höhere rote Fluoreszenz in PD-PTLP-behandelten Krebszellen, die auf die höhere Internalisierung der Nanopartikel zurückgeführt wird (Abb. 3a). Das Ergebnis der CLSM-Daten zeigt, dass der auf der Zellmembran exprimierte PD-L1-Rezeptor von PD-L1-mAb erkannt wurde, der auf der Nanoliposom-Oberfläche konjugiert war. In den PTLP-behandelten Krebszellen war ein unspezifischer oder passiver Aufnahmemechanismus offensichtlich. Die PD-L1-Zielspezifität wurde durch ein PD-L1-mAb-Vorbehandlungsexperiment weiter bestätigt. Die SGC7901/ADR-Zellen wurden mit PD-L1-mAb vorbehandelt und 30 min inkubiert. Die Zellen wurden dann mit PD-PTLP und PTLP exponiert und 3 h inkubiert. Wie gezeigt (Abb. 3b), zeigten mit PD-L1-mAb vorbehandelte Zellen im Vergleich zu nicht behandelten Zellen eine signifikant geringere rote Fluoreszenz, was darauf hindeutet, dass PD-L1-mAb von den oberflächenexprimierten Rezeptoren verbraucht wurde und keine zusätzlichen Rezeptoren für die Bindung verfügbar waren und Internalisierung, was zu einer geringeren Aufnahme von Nanopartikeln und einer geringeren Internalisierung führt. Diese CLSM zeigten eindeutig die Targeting-Spezifität von PD-PTLP in SGC7901/ADR-Krebszellen.
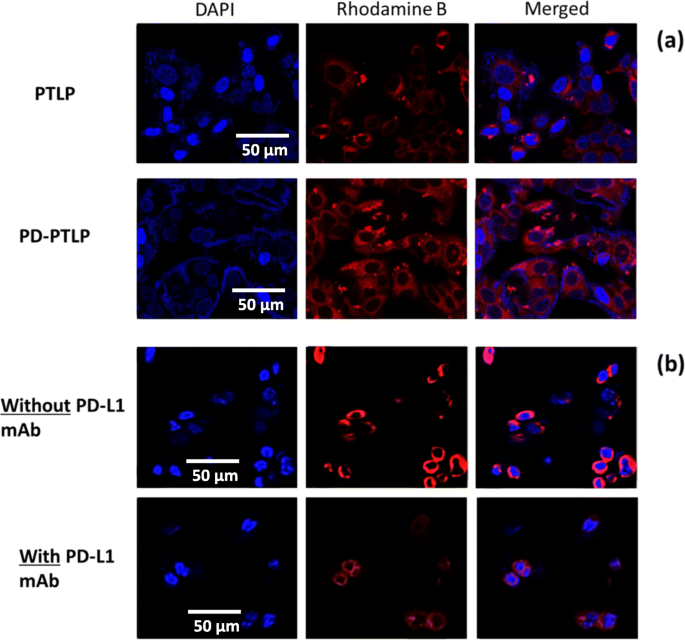
a Konfokale Laser-Scanning-Mikroskopie (CLSM)-Bilder von SGC7901/ADR-Zellen nach Inkubation mit PTLP und PD-PTLP für 3 h; CLSM-Bilder von mit/ohne PD-L1-mAb vorbehandelten SGC7901/ADR-Zellen nach Inkubation mit PD-PTLP für 3 h. Rhodamin B wurde als Fluoreszenz-Tracker verwendet und DAPI wurde verwendet, um den Kern der Krebszellen zu färben
Dual Wirkstoff-beladene Nanoliposomen verstärken die antiproliferative Wirkung
Für die Kombinationstherapie wurden unterschiedliche Verhältnisse von zwei Medikamenten (PTX und TQD) verwendet, um das Ausmaß der synergistischen oder additiven Wirkung auf die resistenten Magenkrebszellen zu bestimmen. Zur Berechnung des Isobologramms und des Kombinationsindex (CI) wurde die Software CalcuSyn (Biosoft, Version 2.1) verwendet. Der Isobologramm-Plot könnte anhand der Chou-Talalay-Gleichung erklärt werden. Die CI-Werte sind durch synergistisch (CI <0,9), additiv (CI =1) und antagonistisch (CI> 1) gekennzeichnet. Wie gezeigt, ergaben alle Kombinationsverhältnisse von PTX und TQD einen CI-Wert von <1, was auf einen synergistischen Wirkmechanismus hindeutet (Abb. 4a). Genauer gesagt wurde die höchste Synergie bei einem Gewichtsanteil von 1/0,5 (P/T) beobachtet, während der Synergiegrad mit der Zunahme des TQD-Gewichtsanteils abnahm, was die Bedeutung der Anwesenheit von zwei Arzneimitteln in der spezifischen Gewichtsfraktion anzeigt. Eine zu niedrige und zu hohe Konzentration von TQD in einer Kombinationsbehandlung ergab nicht die beste synergistische Wirkung. Für alle In-vitro-Experimente haben wir in der Studie das Verhältnis P/T =1/0,5 verwendet.
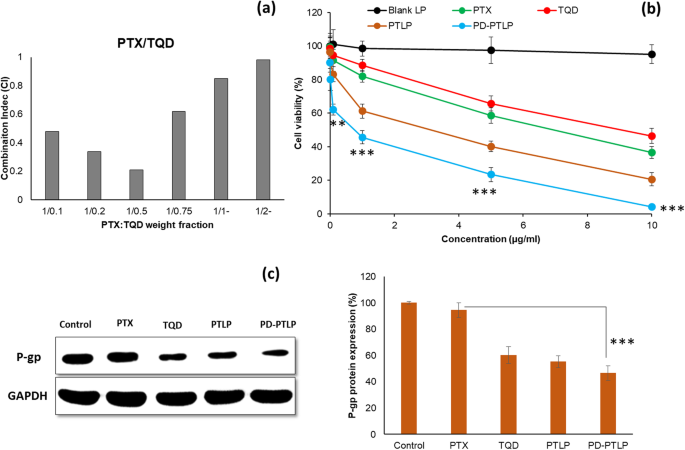
a Kombinationsindex (CI) verschiedener Gewichtsfraktionen von PTX und TQD in SGC7901/ADR-Zellen. Der Kombinationsindex wurde von Calcusyn TM . ausgewertet Software. b In-vitro-Zelllebensfähigkeit von SGC7901/ADR-Zellen nach Behandlung mit verschiedenen Konzentrationen von freiem PTX, TQD, PTLP und PD-PTLP für eine Inkubationszeit von 24 Stunden. c Western-Blot-Analyse der p-gp-Expression in SGC7901/ADR-Zellen nach Behandlung mit entsprechenden Formulierungen. **p <0,01 und ***p <0,001 ist der statistische Unterschied zwischen freiem PTX und der mit PD-PTLP behandelten Gruppe
Die in-vitro-zytotoxische Wirkung von Einzel- und Kombinationsarzneimitteln wurde nach 24-stündiger Inkubation mittels MTT-Protokoll bestimmt. Wie in 4b gezeigt, hatte leeres NP keinen Einfluss auf die Lebensfähigkeit der Zellen, wodurch die Möglichkeit einer Beeinträchtigung der Endergebnisse ausgeschlossen wurde. Die Monotherapie mit PTX und TQD zeigte jedoch eine konzentrationsabhängige zytotoxische Wirkung in den resistenten Magenkrebszellen; es blieb hinter einer nennenswerten Wirksamkeit bei der Behandlung zurück. Die antiproliferative Wirkung eines einzelnen Wirkstoffs wurde bemerkenswert verbessert, wenn er mit dem zweiten in einem Nanoliposom verkapselten Wirkstoff kombiniert wurde. The combination of PTX and TQD resulted in obvious synergistic effect compared to that of individual drugs alone. Moreover, PD-L1 mAb-conjugated nanoliposome (PD-PTLP) exhibited the strongest anti-proliferative effect indicating the influence of the targeting ligand on the nanoparticle surface. This enhanced cell killing in the PD-L1-targeted treatment group might be attributed to the high cellular internalization of PD-L1-targeted nanoliposomes by SGC7901/ADR cells consistent with the cellular uptake analysis. The IC50 value of PD-PTLP was 0.76 μg/ml compared to 6.58 μg/ml and 7.64 μg/ml for PTX and TQD, respectively. A ten-fold decrease in IC50 value of PD-PTLP clearly indicates that resistance to PTX in p-gp overexpressing SGC7901/ADR was reversed by TQD. Our in vitro results showed that TQD was effective in reversing the multidrug resistance in SGC7901/ADR cells. Results also showed that nanoliposomes retained the pharmacological actions of encapsulated drugs and released the drug in a controlled manner in the cancer cells. The combination therapy with PTX and TQD enhanced the anticancer efficacy with increased synergistic activity, outperforming the minimal advantages of monotherapy and possible associated side effects. Overall, combination treatment of PTX with an effective p-gp inhibitor in nanoliposome could be a promising strategy to overcome MDR and treat gastric cancers.
In order to evaluate the molecular mechanism, Western blot analysis was performed on SGC7901/ADR. As shown (Fig. 4c), PTX did not have any effect on the p-gp protein expression while on the contrary, TQD significantly downregulated the p-gp expression confirming its pharmacological role as a p-gp inhibitor. Interestingly, combination drug-based PTLP and PD-PTLP showed insignificant difference in protein expression compared to that of TQD-treated cancer cells. The result demonstrated the advantage of loading PTX and TQD (P-gp inhibitor) together in a single nanocarrier system. The Western blot result could be corroborated with the cell viability results where combination of PTX + TQD reversed the MDR and exhibited higher anticancer efficacy in gastric cancer cells.
Apoptosis analysis by flow cytometer
Apoptosis analysis of individual formulation was evaluated by Annexin V-FITC/PI staining method using flow cytometer. Results of apoptosis are presented in Fig. 5a. A shown, control cells did not show any sign of apoptosis, whereas free PTX and TQD exhibited obvious increase in the apoptosis cells. Combination drug-based PTLP showed two-fold higher apoptosis compared to that of individual drugs indicating the synergistic anticancer effect of the formulations. More importantly, PD-PTLP showed the highest apoptosis of cancer cells with around 60% under apoptosis region. Enhanced apoptosis effect of PD-PTLP was attributed to higher internalization of dual-drug-loaded nanocarriers and synergistic potential of PTX and TQD in a ratiometric manner. The p-gp silencing effect of TQD in combinational regimen enhanced the anticancer effect of PTX in the cancer cells. The apoptosis rate of individual drug was in the range between 20 and 25% while around 60% of apoptosis cells were observed for PD-PTLP-treated cells. The PD-PTLP induced more apoptosis than free drugs and non-targeted liposomes, suggesting that the PD-L1 could deliver PTX/TQD more efficiently to induce apoptosis of the SGC7901/ADR cells.
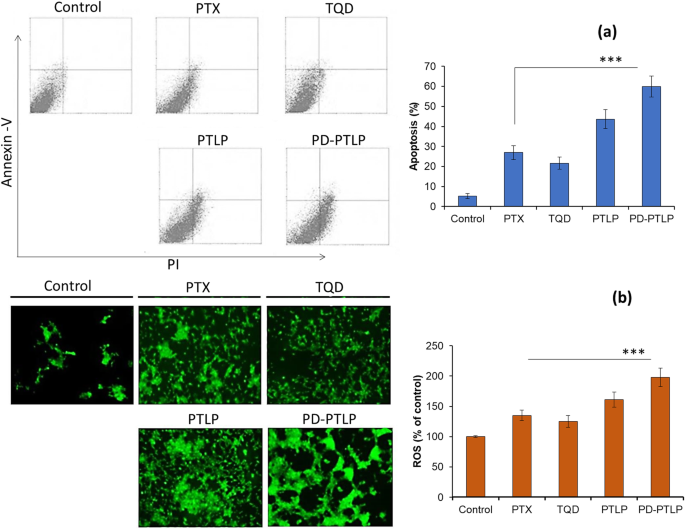
a Apoptosis assay of SGC7901/ADR cells after staining with Annexin V/PI combo using flow cytometer. The cells were treated with a fixed concentration of 2 μg/ml. b Reactive oxygen species (ROS) analysis of SGC7901/ADR cells using 2,7-dichlorofluorescin diacetate (DCFH-DA) as a probe. ***p <0.001 is the statistical difference between free PTX and PD-PTLP-treated group
Intracellular ROS level determination
We have explored the ability of individual drug and dual drug to affect the redox state of the cancer cells cell by evaluating the level of reactive oxygen species (ROS) in gastric cancer cells. ROS levels in cancer cell were evaluated by DCFH-DA (green fluorescence). Quantitative ROS data are presented in Fig. 5b. As shown, non-treated cells did not have any sign of ROS; however, PTX or TQD did induce appreciable levels of ROS generation. Importantly, TPLP and PD-TPLP triggered a significantly higher levels of ROS compared to that of free PTX or TQD or non-treated control cells. A remarkably higher ROS indicates the potential of PD-TPLP to promote higher apoptosis. Microscopic images corroborate with the quantitative results with brightest and higher intensity green fluorescence compared to untreated or free PTX or TQD treated cancer cells. The higher intensity of green fluorescence is an indication of higher ROS production. Oxidative stress such as ROS is considered to be an important indicator of cellular cytotoxicity. Studies have shown that induction of ROS induce a scores of physiological events including DNA damage, inflammation, and cell apoptosis.
Combination of PTX and TQD inhibited growth in drug-resistant tumors
Finally, therapeutic efficacy and toxicity parameters of formulations were investigated on drug-resistant SGC7901/ADR xenograft tumor model (Fig. 6a). The drugs were intravenously administered at a fixed dose of 5 mg/kg for every 3 days with a total of three injections. The PTX/TQD was administered at a fixed weight fraction of 1/0.5. On the expected line, free PTX and free TQD did not show any inhibitory effect on the growth of MDR tumors, suggesting the fact that the SGC7901/ADR cells manifest drug tolerance on the proliferation of MDR tumors. P-gp inhibitor (TQD) though efficient in inhibiting the drug efflux pumps however does not convert into improved therapeutic outcome. In comparison, combination of PTX + TQD (PTLP) displayed a significant inhibition of growth of drug-resistant tumors. The best antitumor efficacy was observed with PD-PTLP which was three-fold effective compared to control, 2.5 compared to free drugs, and approximately two-fold effective in reducing the tumor burden compared to non-targeted formulations (p <0.05; p <0.001). The final tumor volume of control, free PTX, TQD, PTLP, and PD-PTLP was ~ 2000 mm 3 , ~ 1650 mm 3 , 1625 mm 3 , ~ 1000 mm 3 , and ~ 650 mm 3 , bzw. Free drugs were slightly effective during the initial time point; however, they grew the same as that of non-treated control group. Results clearly reveal the potential of combination of PTX + p-gp inhibitor as a unique strategy to effectively control the tumor burden. The extensive tumor suppression in PD-PTLP clearly suggests the greater antitumor efficacy of the targeted formulations group. The tumors were extracted and weighed; tumor weights were consistent with the tumor volume data (Fig. 6b). PD-PTLP-treated mice group showed the smallest tumor compared to any other formulation-treated group (p <0.001). To further verify the inhibitor effect of individual tumors, tumors were subjected to TUNEL assay (Fig. 6c). As shown, PD-PTLP showed the large swaths of apoptosis staining compared to non-treated control or free drugs. PD-PTLP showed apparent apoptosis traits with disorganized cell arrangements. The prominent tumor killing effect of PD-PTLP displays the greater cancer cell inhibition in drug-resistant tumor cells. The excellent efficacy of PD-PTLP was mainly attributed to the presence of targeted ligand (PD-L1 mAb) which binds with the respective receptors and increases the intracellular concentrations. The presence of combination regimen and release in a controlled manner for prolonged time also contributed for its enhanced efficacy. In addition, dense hydrophilic PEG surface corona might offer excellent physical stability to the particles and could potentially avoid the unnecessary protein absorption and avoid rapid clearance. The long circulation and nano-scaled size in turn benefit the higher accumulation of particles in the tumor tissues [31,32,33].
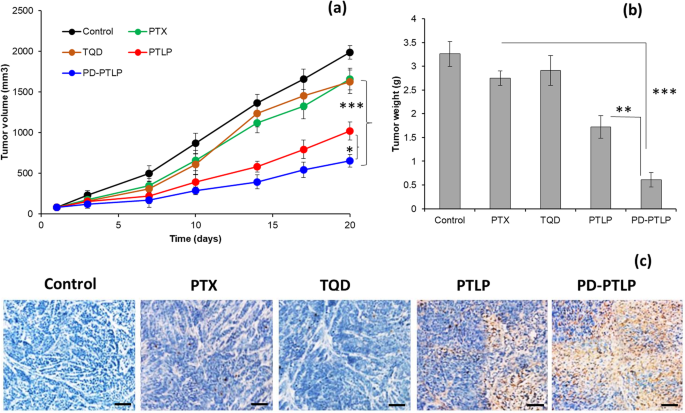
In vivo antitumor efficacy of different formulations against multidrug resistant (MDR) SGC7901/ADR tumors; a tumor volume, b tumor weight analysis, and c TUNEL assay of tumor tissues. The mice were administered with a fixed dose of 5 mg/kg with duration of three times for three administrations. Apoptotic cells wells were evaluated by TUNEL assay. *p <0.05 and **p <0.05 (PTLP vs. PD-PTLP), ***p <0.001 (PTX vs. PD-PTLP)-treated group.
Systemic toxicity analysis
The change in body weight is a good indicator of systemic toxicity. As shown (Fig. 7a), mice treated with free PTX shed ~ 20% of body weight on day 10 which gradually decreased to regain the original body weight toward the end of the study. Loss of more than 5% of body weight is considered to cause severe internal toxicity and 20% of body weight loss is considered a significant adverse effect of free drugs [31]. On the contrary, PTLP or PD-PTLP did not cause any such loss of body and the mice remain healthy throughout the study period indicating the safety index of the nanoliposomes. Delivery system with no systemic toxicity and enhanced antitumor efficacy is considered to be highly effective in tumor treatment. The safety of nanoparticles was further studied by measuring plasma levels of enzymes. Plasma levels of aminotransferases (AST and ALT) are measured following the 24-h administration of respective formulations (Fig. 7b, c). As shown, free PTX resulted in significant increase (p <0.01) in the levels of AST and ALT while PD-PTLP and PTLP were insignificantly different compared to that of non-treated control. AST is released in serum upon organ damage such as heart, kidney, or liver while ALT is specifically released in case of liver injury [34]. The levels of AST and ALT serves as a specific indicator of organ damage and in this regard PD-PTLP showed to be a safe carrier.
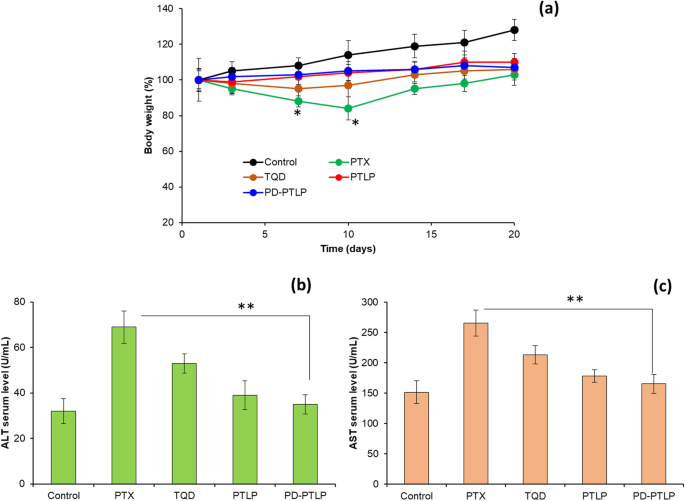
Systemic toxicity analysis of individual formulations in SGC7901/ADR tumors; a mice body weight analysis; b , c blood biochemical evaluation of serum levels of AST and ALT as a systemic toxicity parameters. *p <0.05 and **p <0.01 is the statistical difference between free PTX and PD-PTLP treated group
Verfügbarkeit von Daten und Materialien
All data generated or analyzed during this study are included in this published article and its supplementary information files.
Abkürzungen
- EPR:
-
Verbesserte Permeations- und Retentionswirkung
- PD-PTLP:
-
PD-L1 mAb-conjugated PTX and TQD-loaded nanoliposomes
- P-gp:
-
P-glycoprotein
- PTLP:
-
PTX and TQD-loaded nanoliposomes
- PTX:
-
Paclitaxel
- TQD:
-
Tariquidar
Nanomaterialien
- 131I-gespurte PLGA-Lipid-Nanopartikel als Wirkstoffträger für die gezielte chemotherapeutische Behandlung von Melanomen
- Ultrasensitiver Biosensor zum Nachweis von Vibrio cholerae-DNA mit Polystyrol-Co-Acrylsäure-Komposit-Nanosphären
- Die Herstellung einer Au@TiO2-Dotter-Schale-Nanostruktur und ihre Anwendungen für den Abbau und den Nachweis von Methylenblau
- Laser- und Transporteigenschaften von Poly[(9,9-dioctyl-2,7-divinylenfluorenylen)-alt-co-(2-methoxy- 5-(2-Ethylhexyloxy)-1,4-phenylen)] (POFP) für die Anwendung diodengepumpter organischer Festkörpe…
- Entwicklung der Kontaktfläche bei Normallast für raue Oberflächen:von atomaren zu makroskopischen Skalen
- Kontrollierte Synthese von BaYF5:Er3+, Yb3+ mit unterschiedlicher Morphologie zur Verbesserung der Aufkonversionslumineszenz
- Antikörper-konjugierte Silica-modifizierte Goldnanostäbchen für die Diagnose und photothermische Therapie von Cryptococcus neoformans:ein In-vitro-Experiment
- Graphenunterstützte thermische Grenzflächenmaterialien mit einem zufriedenstellenden Grenzflächenkontaktniveau zwischen Matrix und Füllstoffen
- Spinpolarisierter Transport und Spin-Seebeck-Effekt in Dreifachquantenpunkten mit spinabhängigen Interdot-Kopplungen
- Eine neuartige Nanocone-Cluster-Mikrostruktur mit Antireflexions- und superhydrophoben Eigenschaften für Photovoltaikanlagen



