Biokompatible 5-Aminolävulinsäure/Au-Nanopartikel-beladene ethosomale Vesikel für die transdermale synergistische photodynamische/photothermische In-vitro-Therapie von hypertrophen Narben
Zusammenfassung
Biokompatibles 5-Aminolävulinsäure/Au-Nanopartikel-beladenes ethosomales Vesikel (A/A-ES) wird mittels Ultraschall für die synergistische transdermale photodynamische/photothermische Therapie (PDT/PTT) von hypertropher Narbe (HS) hergestellt. Unter Verwendung von Ultraschall werden Au-Nanopartikel (AuNPs) synthetisiert und gleichzeitig in ethosomale Vesikel (ES) ohne toxische Agenzien geladen, und 5-Aminolävulinsäure (ALA) wird auch in ES mit 20% der Einschlusseffizienz (EE) geladen. Das präparierte A/A-ES zeigt aufgrund des plasmonischen Kopplungseffekts zwischen benachbarten AuNPs in demselben A/A-ES eine starke Absorption bei 600–650 nm, was gleichzeitig A/A-ES zur Erzeugung von Wärme anregen und die Quantenausbeute von . erhöhen kann reaktive Sauerstoffspezies (ROS) unter Verwendung eines 632 nm-Lasers. In-vitro-Studie zur transdermalen Penetration zeigt, dass A/A-ES als hocheffizienter Wirkstoffträger wirkt, um die Penetration von ALA und AuNPs in HS-Gewebe zu verbessern Unter Verwendung menschlicher hypertropher Narbenfibroblasten (HSF) als therapeutische Ziele zeigt die synergistische PDT/PTT von HS, dass A/A-ES die Quantenausbeute von ROS durch photothermischen Effekt und lokalisierte Oberflächenplasmonenresonanz (LSPR) von AuNPs erhöhen könnte, was zu einem hohen Niveau führt von Apoptose oder Nekrose. Kurz gesagt, das präparierte A/A-ES zeigt eine bessere synergistische PDT/PTT-Effizienz für HSF als die individuelle PDT und PTT, was eine ermutigende Perspektive für die Behandlung von HS bietet.
Hintergrund
Hypertrophe Narben (HS), ein häufiges und unvermeidliches Problem nach kutanen Hautverletzungen, haben eine viel dickere fibrotische Dermis als normale Haut [1, 2]. Histopathologisch zeigt HS die Zunahme hypertropher Narbenfibroblasten (HSF), die wellenförmig angeordnet sind, sich an der Epitheloberfläche orientieren und knötchenförmige Strukturen bilden [3]. Obwohl klinisch verschiedene Behandlungen verfügbar sind, gibt es bei HS-Behandlungen aufgrund der zahlreichen Einschränkungen viele Herausforderungen. Die intraläsionale Injektionstherapie ist in der klinischen Praxis weit verbreitet. Sie wird jedoch sowohl durch unangenehme Operationen als auch durch Nebenwirkungen wie dauerhafte Hypopigmentierung und Hautatrophie eingeschränkt [4]. Die Drucktherapie ist für Nebenwirkungen wie Gewebeischämie sowie einen abnehmenden Gewebestoffwechsel begrenzt [5]. Um diese Einschränkungen zu überwinden, dient die Lasertherapie als topische und nicht-invasive Modalität, die seit mehr als 25 Jahren in HS-Behandlungen entwickelt und angewendet wird, indem die Vorteile der Laserbestrahlung genutzt werden [6]. Generell lässt sich die Lasertherapie nach den unterschiedlichen Prinzipien in die photodynamische Therapie (PDT) und die photothermische Therapie (PTT) einteilen.
Die PDT wurde zur Behandlung von HS mit den Vorteilen ihrer hohen Selektivität und geringen Nebenwirkungen eingesetzt [7]. Sein Prinzip entwickelt zwei Schritte:(a) Photosensibilisatoren aggregieren vorzugsweise in HSF und (b) Photosensibilisatoren produzieren unter Bestrahlung eines geeigneten Lasers zytotoxische reaktive Sauerstoffspezies (ROS), die zur Apoptose von HSF führen [8, 9]. Unter verschiedenen Photosensibilisatoren hat sich 5-Aminolävulinsäure (ALA) als ausgezeichneter Kandidat für eine lokale Behandlungsmethode in der Dermatologie ohne signifikante Nebenwirkungen erwiesen. Daher wurde die ALA-basierte PDT (ALA-PDT) weit verbreitet in der HS-Behandlung mit der Marktzulassung der US-amerikanischen Food and Drug Administration im Jahr 2010 eingesetzt [10]. Seine Effizienz ist jedoch aus zwei Gründen umstritten:(a) die schlechte Durchdringbarkeit von ALA sowohl in HS-Gewebe als auch in HSF und (b) die geringen Quantenausbeuten von ROS. Um eine ausgeprägte Wirkung zu erzielen, wird in der Klinik ein hochdosierter ALA- oder High-Level-Laser eingesetzt. Leider führt hochdosiertes ALA zu einer Schädigung der Talgdrüse und der Epidermis, und High-Level-Laser neigen dazu, gesundes Gewebe zu verletzen. Daher wurde der Verbesserung der Durchdringbarkeit von ALA und der Quantenausbeute von ROS bei der PDT-Behandlung von HS viel Aufmerksamkeit geschenkt. Kürzlich wurde festgestellt, dass ethosomale Vesikel (ES), ein speziell entwickeltes Liposom, die Barriere bei HS für die topische Verabreichung überwinden und signifikante Fortschritte erzielen können [11, 12]. In unserer früheren Arbeit ist das vorbereitete ALA-beladene ES (ALA-ES) in der Lage, viel mehr ALA in das HS zu liefern als das herkömmliche System mit hydroalkoholischen Lösungen [13]. Daher kann ES die Durchdringbarkeit von ALA verbessern, um die PDT-Wirksamkeit von HS zu verbessern. Inzwischen verspricht eine neue synergistische Behandlungsmethode, die PDT mit PTT kombiniert, sowohl die Quantenausbeute von ROS als auch die Behandlungswirksamkeit von HS zu verbessern.
Die PTT ist auch ein außergewöhnlicher theranostischer Ansatz für verschiedene Erkrankungen [14, 15]. Es wurde bisher erfolgreich in der klinischen Behandlung des HS eingesetzt [16]. Sein Mechanismus entwickelt die Gewinnung von Lichtenergie, die Erzeugung von Wärme und führt dann zu Gewebeverdampfung, Koagulation, HSF-Apoptose und Kollagendenaturierung. PTT hat jedoch schwere Nebenwirkungen bei der HS-Behandlung, wie Nässen, Geschwüre und brennendes Unbehagen, aufgrund seiner geringen Selektivität gegenüber HS-Gewebe mit High-Level-Laser [4]. Kürzlich wurde PTT, die Nanotechnologie überbrückend, als potenzielle HS-Behandlung mit hochselektiver und minimal-invasiver photothermischer Wirkung angesehen. Und noch wichtiger ist, dass PTT basierend auf Au-Nanopartikeln (AuNPs) als wirksame Photoadsorptionsmittel aus zwei Gründen die Quantenausbeute von ROS steigert:-abhängig, und [17] (b) AuNPs können mit ALA konjugieren und die Quantenausbeuten von ROS aufgrund der lokalisierten Oberflächenplasmonenresonanz (LSPR) erhöhen [18, 19]. Daher verspricht die ALA/AuNP-basierte synergistische photodynamische/photothermische Therapie (PDT/PTT) die derzeitigen Einschränkungen sowohl der PDT als auch der PTT in der HS-Behandlung zu überwinden.
Neuere, AuNP-basierte synergistische PDT/PTT wurden in verschiedenen Krebstherapien durch Injektionen weit verbreitet verwendet [20, 21]. Anders als bei Krebserkrankungen ist HS für die topische Anwendung geeignet [22]. Die Kollagenbündel in der HS-Dermis stellen jedoch große Barrieren für das Eindringen von ALA und AuNPs dar, was die synergistische PDT/PTT-Behandlungseffizienz für HS einschränkt. Daher ist es für eine synergistische PDT/PTT mit maximaler therapeutischer Wirksamkeit und minimalen Nebenwirkungen entscheidend, wie ALA und AuNPs gleichzeitig in HS eindringen können [23, 24]. Darüber hinaus sollte eine geeignete synergistische PDT/PTT auf ALA/AuNP-Basis auch die folgenden Bedingungen erfüllen:(a) AuNPs können Wärme durch den He-Ne-Laser erzeugen, der in ALA-PDT verwendet wird, und (b) das Abgabesystem sollte hoch sein biokompatibel. Die beschriebenen verschiedenen Photosensibilisatoren/AuNPs können jedoch wegen ihrer Durchdringbarkeit und schlechten Biokompatibilität nicht durch eine topische transdermale Verabreichung und HS-Behandlung angewendet werden [25].
In dieser Arbeit werden ALA/AuNP-beladene ES (A/A-ES) mit ausgezeichneter Biokompatibilität und Penetrationsfähigkeit für die synergistische PDT/PTT von HS entwickelt. Das biokompatible A/A-ES wird sowohl aus AuNPs als auch mit ALA-beladenem ES über einen Ultraschallprozess ohne toxische Mittel hergestellt. Das präparierte A/A-ES zeigt eine starke Absorption im Bereich von 600–650 nm als Ergebnis der plasmonischen Kopplung zwischen benachbarten AuNPs, die in A/A-ES gemeinsam geladen sind. Dies ermöglicht die Verwendung eines He-Ne-Lasers, um A/A-ES zu stimulieren, um gleichzeitig Wärme und ROS zu erzeugen, was die HSF-Apoptose fördern könnte. A/A-ES weist in der In-vitro-Studie eine ausgezeichnete Penetrationsfähigkeit auf, um gleichzeitig ALA und AuNPs in HS einzubringen. Mit HSF als Ziel wird schließlich die In-vitro-Effizienz der PDT/PTT für HS anhand der Akkumulation von intrazellulärem Protoporphyrin IX (PpIX), der Quantenausbeute von ROS und der Apoptose von HSF untersucht. Darüber hinaus wird die Penetrationsfähigkeit in HSF auch durch TEM beobachtet. Aufgrund des synergistischen Effekts erleichtert A/A-ES sowohl ALA als auch AuNPs, gleichzeitig in HS und HSF einzudringen, was zu einer höheren Zellapoptose im Vergleich zu individueller PTT oder PDT führt. Kurz gesagt, A/A-ES ist ein vielversprechendes transdermales Verabreichungssystem für die topische ALA- und AuNP-Verabreichung, hat großes Potenzial bei der synergistischen PDT/PTT von HS und öffnet ein neues Fenster für die HS-Behandlung.
Ergebnisse und Diskussionen
Die Charakterisierung von A/A-ES
Ultraschall war aus zwei Gründen der Schlüsselparameter bei der Herstellung von A/A-ES:(a) AuNPs konnten ohne toxische Mittel durch Ultraschall gebildet werden, was A/A-ES mit Biokompatibilität ausstattete; (b) Ultraschall könnte die Lipiddoppelschichten neu anordnen, um mehr Vesikel mit kleinen Größen und relativ größeren inneren Kernen zu bilden, die mehr ALA und AuNPs beladen könnten. In dieser Arbeit wurden AuNPs wie in den folgenden Schemata beschrieben gebildet:(a) In den Blasen wurden durch Homolyse von H2 . hochreaktive H•- und OH•-Radikale erzeugt O (Gl. 1), (b) die oxidierenden Radikale H• könnten das Alpha H von CH3 . abstrahieren CH2 OH und bilden ein reduzierendes Radikal CH2 •CH2 OH (Gl. 2), und (c) während einer Pyrolyse innerhalb der Blasen das Radikal CH2 •CH2 OH könnte Au 3+ . reduzieren um AuNPs zu bilden (Gl. 3) [26].
$$ {\mathrm{H}}_2\mathrm{O}\to \mathrm{H}\bullet +\mathrm{OH}\bullet $$ (1) $$ \mathrm{H}\bullet +{\mathrm {CH}}_3{\mathrm{CH}}_2\mathrm{OH}\to {\mathrm{CH}}_2\bullet {\mathrm{CH}}_2\mathrm{OH}+{\mathrm{H} }_2 $$ (2) $$ {\mathrm{Au}}^{3+}+{\mathrm{CH}}_2\bullet {\mathrm{CH}}_2\mathrm{O}\mathrm{H} +\mathrm{OH}\bullet \to\mathrm{AuNPs}+{\mathrm{CH}}_3{\mathrm{CH}}_2\mathrm{O}\mathrm{H}+{\mathrm{H}} _2\mathrm{O} $$ (3)Zunächst wurde A/A-ES durch UV-Vis verifiziert (Abb. 1a). Es hatte eine starke Absorption im Bereich von 600–650 nm als Ergebnis der plasmonischen Kopplung zwischen benachbarten AuNPs im gleichen A/A-ES [20]. Daher könnte es eine 632-nm-Laserbestrahlung verwenden, um gleichzeitig PDT und PTT für HS zu verwenden. Darüber hinaus wies A/A-ES gemäß der DLS-Analyse in Abb. 1b eine relativ enge Größenverteilung auf und die durchschnittliche Größe betrug 166 ± 83 nm. Interessanterweise wurden unbeladenen AuNPs und A/A-ES zwei Größenverteilungen zugeschrieben. Auch der große Unterschied zwischen zwei Verteilungen deutet darauf hin, dass die Menge an A/A-ES viel höher war als die von unbeladenen AuNPs. Die PDT-Effizienz hing von der Menge an ALA ab, die in A/A-ES geladen war. Begünstigt durch die aktive Lademethode des transmembranen pH-Gradienten betrug der EE von ALA 20 %, was höher war als in den berichteten Arbeiten (weniger als 10 %) [27]. Die Morphologie von A/A-ES wurde ebenfalls untersucht. Auf REM-Bildern (Abb. 1c) erschien A/A-ES als intakte kugelförmige lamellare Vesikel mit einer Größe von 200 nm, und AuNPs konnten deutlich beobachtet und in ES geladen werden. Neben den AuNPs erstreckten sich die Lamellen in Abb. 1d auf die AuNP-Oberfläche, was für ES charakteristisch war [28, 29]. Darüber hinaus hatte das vorbereitete A/A-ES, das eine unterschiedliche Anzahl von AuNPs geladen hatte, ähnliche Größen in der zusätzlichen Datei 1:Abbildung S1. Daher wurde A/A-ES unter Ultraschall in die stabile und verformbare Struktur angepasst, was es A/A-ES erleichtert, sich durch engen Raum in HS zu quetschen. Zusammenfassend lässt sich sagen, dass A/A-ES mit 20 % EE von ALA und einer starken Absorption bei 600–650 nm erfolgreich hergestellt wurde. Seine Morphologie wäre auch für die Durchdringbarkeit sehr förderlich, was im Folgenden mit der in vitro-PDT/PTT-Studie übereinstimmt.
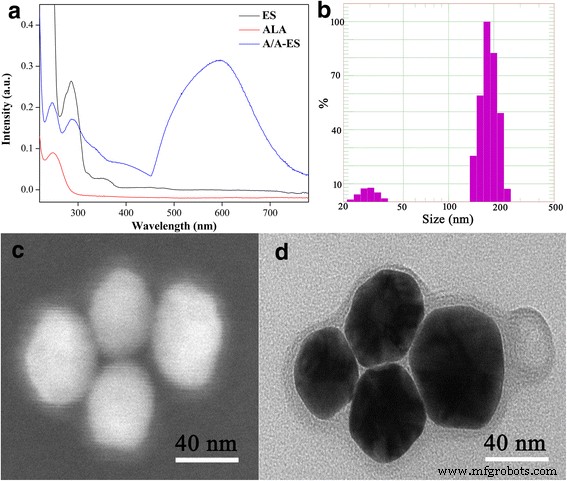
a UV-Vis-Spektren von ES, ALA und A/A-ES. b Die Größenverteilung von präpariertem A/A-ES. c , d Die REM- und TEM-Bilder von A/A-ES
In-vitro-Studie zur transdermalen Penetrabilität von A/A-ES
Die Retention von A/A-ES war ein wichtiger Parameter zur Bewertung der Penetrationsfähigkeit und Behandlungseffizienz von A/A-ES. Daher wurde die Retentionsmenge von ALA und AuNPs in HS mit unterschiedlicher Zeit unter Verwendung von Franz-Diffusionszellen untersucht. Wie in Abb. 2a gezeigt, erreichten sowohl ALA als auch AuNPs aufgrund der Penetrationsverstärkungsfunktion von ES in den ersten 2 h schnell die maximale Retention. Nach Erreichen des Maximums nahmen die Retentionen sowohl von ALA als auch von AuNPs kontinuierlich ab, da A/A-ES das gesamte HS durchdrang. Die Ergebnisse zeigten, dass das A/A-ES eine ausreichende Durchdringbarkeit aufwies. Verglichen mit der angewendeten Dosis von ALA (2 mg) befanden sich 48 % ALA im HS-Gewebe, was für die PDT von HS sprach. Darüber hinaus deuteten dieselben Retentionsänderungen zwischen ALA und AuNPs darauf hin, dass ALA und AuNPs beide in ES geladen wurden, was mit den Ergebnissen von Mikroskopen übereinstimmt. Dem Ergebnis zufolge waren 2 h eine angemessene Verabreichungszeit für die topische Anwendung mit der maximalen Retentionsmenge von A/A-ES. In unseren früheren Arbeiten wurde ES als hocheffizienter Wirkstoffträger angesehen, um die Wirkstoffpenetration in HS-Gewebe zu verbessern [13]. Daher wurde in dieser Arbeit auch die Verteilung und Wirkung von A/A-ES in HS mithilfe von TEM untersucht. Wie in 2b gezeigt, wurde A/A-ES als intakte Struktur in der Dermis gefunden, was darauf hindeutet, dass A/A-ES stabil durch die Epidermis und in die HS-Dermis eindringen konnte. In der in Abb. 2c gezeigten unteren Dermis wurden ES und AuNPs als Trennungszustand beobachtet, was darauf hindeutet, dass A/A-ES sowohl ALA als auch AuNPs freisetzen würde. Interessanterweise könnten AuNPs in der Dermis aggregieren, obwohl sie nicht in ES geladen wurden. Darüber hinaus wurde in Abb. 2d festgestellt, dass sich mehr AuNPs in der Dermis ansammeln, was die plasmonische Kopplung zwischen benachbarten AuNPs bereitstellen könnte, um Lichtenergie zu gewinnen und Wärme zu erzeugen. Kurz gesagt, eine transdermale In-vitro-Durchdringungsstudie zeigte, dass A/A-ES ein hocheffizienter Wirkstoffträger ist, um die Penetration von ALA und AuNP in HS-Gewebe zu verbessern, und die aggregierten AuNPs in der Dermis waren für die Wärmeerzeugung [20]. Daher zeigte die A/A-ES ein großes Potenzial in der synergistischen PDT/PTT für HS.
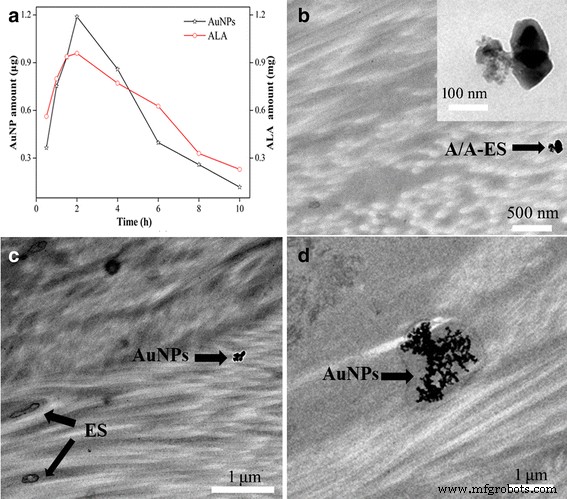
a die Retentionsmenge von ALA und AuNPs. b Die Verteilung von A/A-ES in HS-Gewebe. c Die Verteilung von ES und AuNPs in HS-Gewebe. d Anreicherung von AuNPs im HS-Gewebe
In-vitro-PDT/PTT von HSF
Biokompatibilitäts-Assay
Obwohl die Biokompatibilität von AuNPs in veröffentlichten Arbeiten gut nachgewiesen wurde, sollte in dieser Arbeit auch die Biokompatibilität von A/A-ES zu HSF untersucht werden [30, 31]. Unterschiedliche Konzentrationen von ALA-ES, Au-ES und A/A-ES (basierend auf ALA-Konzentrationen von 0,1 bis 10 mM, Au-ES war die gleiche AuNP-Konzentration wie A/A-ES) wurden mit HSF 12 h lang inkubiert ohne Bestrahlung. Das Ergebnis zeigte, dass bei Konzentrationen von nicht mehr als 2,0 mM mit Zellüberlebensraten von mehr als 90 % keine Dunkelzytotoxizität auftrat. Wenn die Konzentrationen höher als 2,0 mM waren, wurde eine leichte Abnahme der Zellüberlebensraten festgestellt. Die Ergebnisse zeigten, dass A/A-ES die ausgezeichnete Biokompatibilität aufwies und die PDT/PTT in folgenden Studien bei einer Konzentration von 2,0 Mm durchgeführt werden sollte (ca. 14% A/A-ES in Kulturmedien, v /v .) Abb. 3.
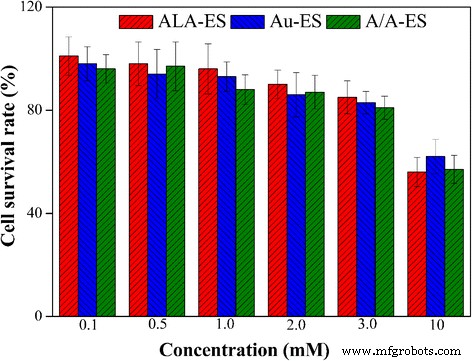
Die Zelllebensfähigkeit von HSF nach Behandlung mit ALA-ES, Au-ES und A/A-ES im Dunkeln für 12 h
PDT/PTT für HSF
A/A-ES könnte Oberflächenpermeabilitätsbarrieren durch die Fusion von A/A-ES mit HSF-Membran überwinden und dann die ALA und AuNPs direkt in das Zellzytoplasma freisetzen [32]. Gemäß dem Mechanismus von ALA-PDT könnte aus A/A-ES freigesetztes ALA im HSF-Zytoplasma in PpIX umgewandelt werden. Mit Laser produzierte PpIX zytotoxische ROS, die zur Zellapoptose führten. Daher wurde CLSM verwendet, um die Akkumulation sowohl von PpIX als auch von ROS in Abb. 4 zu untersuchen [33, 34]. Vor der Laserbestrahlung war die rote Fluoreszenz von PpIX hauptsächlich im Zytoplasma von HSF verteilt. PpIX in HSF, das mit ALA-ES und A/A-ES behandelt wurde, waren viel mehr als das autologe PpIX in HSF, das mit Au-ES behandelt wurde. Darüber hinaus wurde ROS in allen HSF ohne Laserbestrahlung kaum gefunden, was ebenfalls vernünftig war. Nach der Laserbestrahlung waren die PpIX-Intensitäten in HSF, die mit ALA-ES und A/A-ES behandelt wurden, reduziert, und ROS in diesen Zellen konnte leicht mit starker Intensität gefunden werden. Unterdessen zeigte das mit Au-ES behandelte HSF keine Reaktion in PpIX und ROS, da sie nicht genügend autologes PpIX aufwiesen. Interessanterweise konnte A/A-ES bei einem Vergleich der ROS-Intensität, die den AuNPs zugeschrieben wurde, mehr ROS-Erzeugung fördern als ALA-ES. Darüber hinaus lieferte auch die Zellmorphologie weitere Informationen. Das mit ALA-ES behandelte HSF wies den Eumorphismus auf, während das mit Au-ES behandelte HSF ungesunde Vorsprünge aus der Plasmamembran aufwies. Im Gegensatz dazu zeigte sich das mit A/A-ES behandelte HSF als hervorstehende und sich zurückziehende „Blasen“, was das Merkmal absterbender Zellen war [35]. Diese Unterschiede in der ROS-Erzeugung und Zellmorphologie wurden PTT basierend auf AuNPs zugeschrieben, die auch durch Infrarot-Bildgebung in Abb. 5 untersucht wurde. Gemäß dem Mechanismus von AuNPs-PTT könnten AuNPs im HSF-Zytoplasma 632 nm Laser absorbieren und genügend Wärme erzeugen um die Zellen unter Bestrahlung zur Apoptose oder Nekrose zu bringen. Daher wurden die photothermischen Effekte von ALA-ES, Au-ES und A/A-ES mit einer Infrarot-Wärmebildkamera überwacht. Im Vergleich hatten ALA-ES, Au-ES und A/A-ES bei der Bestrahlung eine offensichtlich höhere Temperatur (41,3 °C für Au-ES und A/A-ES, 36,5 °C für ALA-ES). Nachdem der Laser entfernt wurde, sanken alle Temperaturen innerhalb von 1 min schnell auf einen normalen Wert, was darauf hindeutet, dass die Laserbestrahlungsbehandlung sicher sein könnte [36]. Daher könnten in ES geladene AuNPs eine effektive PTT bereitstellen, die auch durch Apoptose- und Nekrose-Assays bereitgestellt wird. Zusammenfassend lässt sich sagen, dass A/A-ES die Quantenausbeute von ROS verbessern und den photothermischen Effekt bereitstellen könnte, um eine ausgezeichnete Effizienz der synergistischen PDT/PTT-Behandlung für HSF zu erreichen.
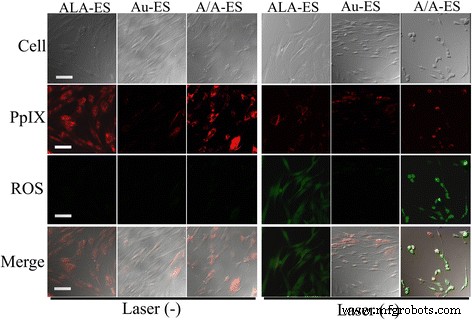
Konfokale Bilder von HSF, die 6 h lang mit ALA-ES, Au-ES und A/A-ES behandelt und ohne/mit Bestrahlungen verfolgt wurden. Der Maßstabsbalken beträgt 100 μm
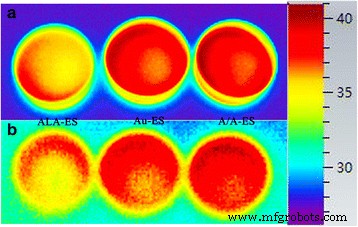
. Infrarotmikroskopische Bildgebung von HSF, behandelt mit ALA-ES, Au-ES und A/A-ES für 6 h unter (a ) und nach der Bestrahlung (b )
Apoptose- und Nekrose-Assay
Die Effizienz von PDT/PTT wurde weiter durch die Apoptose und Nekrose von HSF untersucht, die mit ALA-ES, Au-ES und A/A-ES unter Laserbestrahlung behandelt wurden. Ein Apoptose-Assay wurde unter Verwendung der Durchflusszytometrie-Analyse von Annexin V-FITC und Propidiumiodid (PI)-Doppelfärbung durchgeführt (Abb. 6). Ein Kontrollergebnis zeigte, dass die Laserbestrahlung die Lebensfähigkeit der Zellen nicht beeinflusste ( 6a ). Vor der Bestrahlung zeigten ALA-ES, Au-ES und A/A-ES die gute Biokompatibilität. Nach der Bestrahlung wiesen die mit ALA-ES, Au-ES und A/A-ES behandelten Anteile von sowohl Nekrose als auch Apoptose signifikante Unterschiede auf. Kurz gesagt, es gab einen höchsten Anteil von sowohl Nekrose als auch Apoptose von HSF, der mit A/A-ES behandelt wurde, was mit dem Ergebnis von CLSM übereinstimmte. In 6e zeigte die statistische Analyse der Experimente, dass der nekrotische Zelltod bei der Behandlung mit A/A-ES auf 61,8 % zunahm, was darauf hindeutet, dass A/A-ES eine bessere synergistische PDT/PTT-Effizienz für HSF aufwies als die individuelle PDT ( 47,7% nekrotischer Zelltod) und PTT (24,3% nekrotischer Zelltod). Interessanterweise zeigte das Ergebnis auch, dass PDT im Vergleich zu PTT eine effektivere Rolle bei der HS-Behandlung spielte und PTT auf AuNP-Basis den PDT-Effekt unterstützen könnte. Diese Ergebnisse könnten damit erklärt werden, dass A/A-ES die Quantenausbeuten von ROS erhöhen und den photothermischen Effekt bereitstellen könnte, um eine ausgezeichnete Effizienz der synergistischen PDT/PTT-Behandlung für HSF zu erreichen. Obwohl die EE von ALA bei A/A-ES viel niedriger war als die bei ALA-ES (20 vs. 54%), gab es einen ähnlichen nekrotischen Zelltod sowohl bei A/A-ES als auch bei ALA-ES (61,8 vs. 78 .). %). Dieses Ergebnis könnte dadurch erklärt werden, dass A/A-ES die Quantenausbeute von ROS durch photothermischen Effekt und LSPR von AuNPs erhöhen könnte.
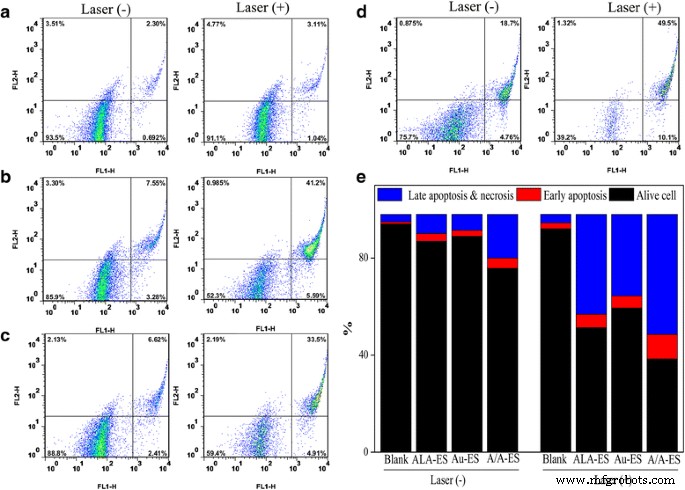
Apoptose-Assay von mit ALA-ES behandeltem HSF (b ), Au-ES (c ) und A/A-ES ohne/mit Laserbestrahlung (d ) und die statistische Analyse von lebenden, frühen apoptotischen und späten apoptotischen und Nekrose (e ). a war die Kontrolle. Laser (-) und (+) bedeuten ohne/mit Laserbestrahlung
Visualisierung von A/A-ES in HSF
Die durch PDT/PTT verursachten Detailänderungen der HSF-Morphologie und -Struktur wurden auch durch Lichtmikroskopie und TEM in Abb. 7 untersucht. ES hatte wie erwartet eine ausgezeichnete Biokompatibilität (Abb. 7a). In ihrem TEM-Bild wies das behandelte HSF neben verschiedenen Organellen im normalen Zytoplasma viel AuNP-Aggregation im Zellzytoplasma auf (die leeren Rahmen in Fig. 7c). Es könnte erklärt werden, dass die Fusion von A/A-ES mit Zellmembranen mehr AuNPs und ALA in HSF liefern könnte. Daher könnten AuNPs aufgrund des stärkeren plasmonischen Kopplungseffekts als effektivere photothermische Quelle fungieren und die Quantenausbeuten von ROS durch LSPR erhöhen. Interessanterweise waren einige AuNPs im gestrichelten Rahmen in Abb. 7c aufgrund von Exozytose außerhalb des HSF, was einmal mehr die ausgezeichnete Biokompatibilität von A/A-ES demonstrierte. Nach der Bestrahlung zeigte HSF das Merkmal absterbender Zellen, also die Vorsprünge aus der Plasmamembran (Abb. 7b) [37]. Aufgrund von ROS und photothermischem Effekt wurden im HSF-Zytoplasma die anschwellenden Mitochondrien und die geplatzte äußere Membran als weitere Indikatoren für den HSF-Tod gefunden (Abb. 7d) [35]. Darüber hinaus wurde auch ES mit seiner charakteristischen Membranstruktur gefunden (rote Rahmen in Abb. 7d). Zusammenfassend lässt sich sagen, dass A/A-ES das Eindringen von ALA und AuNPs in HSF erleichtern und HSF durch synergistische PDT/PTT zerstören könnte.

Die lichtmikroskopischen Bilder von HSF, die zuvor mit A/A-ES behandelt wurden (a ) und nach der Bestrahlung (b ). TEM-Bilder von HSF, die zuvor mit A/A-ES behandelt wurden (c ) und nach der Bestrahlung (d )
Schlussfolgerungen
Biokompatibles A/A-ES wurde leicht für in vitro synergistische PDT/PTT von HS durch Permeation in HS und Zerstörung von HSF hergestellt. Unter Verwendung von Ultraschall wurden AuNPs synthetisiert und gleichzeitig in Abwesenheit jeglicher toxischer Mittel geladen. A/A-ES hatte eine starke Absorption bei 600–650 nm als plasmonischer Kopplungseffekt zwischen benachbarten AuNPs im ES mit einem hohen EE für ALA (ca. 20 %). Eine In-vitro-Studie zur transdermalen Penetration zeigte, dass A/A-ES ein hocheffizienter Wirkstoffträger ist, um die Penetration von ALA und AuNP in HS-Gewebe zu verbessern In-vitro-PDT/PTT für HSF zeigte, dass A/A-ES die Quantenausbeute von ROS durch photothermischen Effekt und LSPR von AuNPs steigern könnte, was zu einem hohen Maß an Zellapoptose oder -nekrose führt. Mit einem Wort, biokompatibles A/A-ES hatte eine bessere synergistische PDT/PTT-Effizienz für HSF als die individuelle PDT und PTT, was eine Perspektive für die Behandlung von HS ermutigt. Weitere Arbeiten werden sich auf die In-vivo-Studie von synergistischer PDT/PTT für HS in Narbenmodellen konzentrieren, und die entsprechenden Arbeiten sind im Gange.
Experimente und Methoden
Die Vorbereitung von A/A-ES
Einhundertachtzig Milligramm Phosphatidylcholin (PC, 95,8% Sojabohnenlecithin, Lipoid GmbH, Deutschland) gelöst in 1,8 ml CH3 CH2 OH, 0,6 ml HAuCl4 (10 mM, Aladdin, Shanghai, China) und 3,6 ml ALA-Citrat-Pufferlösung (CBS, 0,01 M, 12 mg ALA, pH 4,0) wurden wiederum tropfenweise in die PC-Lösung gegeben. Die Mischung wurde 10 min bei 700 U/min gerührt, um eine Vorläuferlösung herzustellen. Wie in Schema 1 gezeigt, wurde die Vorläuferlösung 30 Minuten lang in eine Ultraschallumgebung mit 200 W gestellt, bis sie eine brillante weinrote Farbe aufwies. Dann wurde die Reaktionslösung mit einer Zentrifuge (8000 U/min, 20 min) durchgeführt, um das restliche HAuCl4 . zu entfernen und PC. Zuletzt wurde die Abscheidung in 3 ml hydroalkoholischer ALA-Lösung (ALA-HA, 2 mg/ml ALA, 30% Ethanol) redispergiert und gemäß unserer früheren Arbeit mit einem transmembranen pH-Gradienten-Aktivladungsverfahren inkubiert [13]. Bei der Inkubation diffundierte eine Menge äußerer nichtionisierter ALA durch die ES-Doppelschichten in den inneren sauren wässrigen Kern von ES, und dann wurden sie protoniert und in ES eingeschlossen. Nach der Inkubation wurde A/A-ES hergestellt. In dieser Arbeit wurde ALA-ES gemäß unserer früheren Arbeit mit der gleichen ALA-Konzentration wie A/A-ES hergestellt. AuNP-beladenes ES (Au-ES) wurde als A/A-ES ohne ALA mit der gleichen AuNP-Konzentration wie A/A-ES hergestellt.
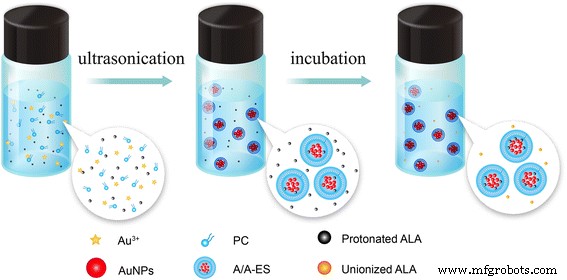
Schematische Darstellung der Vorbereitung von A/A-ES
Die Charakterisierung von A/A-ES
A/A-ES wurden mit Phosphorwolframsäure (1,5 Gew.-%) negativ gefärbt und dann mit einem Transmissionselektronenmikroskop (TEM, JEOL, Japan, Beschleunigungsspannung von 120 kV) beobachtet. A/A-ES wurde auch mit einem Rasterelektronenmikroskop (REM, JEOL, Japan, Beschleunigungsspannung von 10 kV) untersucht. Die A/A-ES-Größenverteilung wurde durch dynamische Lichtstreuungs(DLS)-Analyse in einem NiComp 380ZLS-Inspektionssystem (Nicomp, USA) bestimmt. ALA wurde durch einen Fluoresceamin-Derivatisierungsansatz bestimmt, und die Details wurden in Zusatzdatei 1 gezeigt. Die Einschlusseffizienz (EE) von ALA, die durch eine Ultrafiltrationsmethode bestimmt wurde, wurde in Zusatzdatei 1 gezeigt. Schließlich wurden UV-Vis-Spektren an a . durchgeführt Varian Cary 50 UV-Vis-Spektrophotometer (Perkin Elmer, USA).
In-vitro-Durchdringungsstudie von Franz Diffusion Cells
Die Durchlässigkeitsstudie von A/A-ES wurde unter Verwendung von Franz-Diffusionszellen mit 2,8 cm 2 . durchgeführt effektive Durchdringungsfläche. Die Rezeptorzellen einschließlich der Spender- und Rezeptorkompartimente wurden durch ein zirkulierendes Wasserbad bei 37 °C gehalten. HS-Gewebe wurden mit Einwilligung nach Aufklärung im Shanghai Ninth People’s Hospital und den ethischen Richtlinien der Deklaration von Helsinki von 1975, die vom Shanghai Ninth People’s Hospital genehmigt wurden, entnommen. Frisches HS-Gewebe ohne Fettgewebe (weniger als 24 h nach Exzision) wurde auf ein Rezeptorkompartiment mit Stratum corneum nach oben zum Spenderkompartiment montiert. Ein Milliliter A/A-ES wurde in die Spenderkammer gegeben, und dann wurde die Spenderkammer mit Parafilm bedeckt, um eine Verdunstung zu verhindern. Nach der Penetration mit unterschiedlicher Zeit wurden die HS-Gewebe unverzüglich gewaschen, um restliches A/A-ES auf der HS-Oberfläche zu entfernen. Um die Retentionsmenge von ALA und AuNPs in HS zu akkumulieren, wurden HS-Gewebe in kleine Stücke geschnitten und ALA in HS-Geweben wurde durch Dialyse in PBS für 24 Stunden extrahiert. Die Extraktlösungen wurden auf die Retentionsmenge von ALA in HS-Gewebe analysiert. Die in Dialysebeuteln zurückgehaltenen HS-Gewebe wurden auch durch induktiv gekoppelte Plasma-Massenspektrometrie (ICP-MS) auf die Retentionsmenge von AuNP analysiert. Nach 2 h Permeation mit ALA-ES wurde das HS-Gewebe gewaschen, vorfixiert, dehydriert, infiltriert und nachfixiert. Nachdem sie in Epoxidharz eingebettet waren, wurden sie als Ultraschnitte (50 nm Dicke, senkrecht zur Epidermis) geschnitten und mit TEM bei einer Beschleunigungsspannung von 120 kV beobachtet.
In-vitro-PDT/PTT für HSF
Zellkultur
HSF wurde wie folgt isoliert und kultiviert:Die frischen HS-Gewebestücke (1 mm 3 , weniger als 6 h nach der Exzision) wurden unter Verwendung von Kollagenase Typ I (Invitrogen, USA) verdaut, um eine Einzelzellsuspension zu erhalten. Das HSF wuchs in Dulbecco’s Modified Eagle Medium (DMEM, Invitrogen, USA) mit 10 % fötalem Rinderserum (FBS, Gibco, USA) bei 37 °C und 5 % CO2 . Das Kulturmedium sollte alle 3 Tage gewechselt werden und die Zellen wurden passagiert, wenn sie zu 80 % konfluent waren. In den folgenden Experimenten wurden die passagierenden Zwei- und Drei-Zellen verwendet.
Biokompatibilitätstest
Bei der Bewertung der Biokompatibilität von A/A-ES wurden HSF in 96-Well-Platten bei 2 × 10 3 . ausgesät Zellen/Well. Das Kulturmedium wurde durch FBS-freies Medium und frisch zubereitetes ALA-ES, Au-ES bzw. A/A-ES in unterschiedlichen Konzentrationen ersetzt. Nach 12 h wurde die Lebensfähigkeit der Zellen mit einem Zellzählkit-8 (CCK-8, Dojindo, Japan) gemäß den Anweisungen des Herstellers gemessen.
PDT/PTT-Verfahren
HSF wurden in 12-Well-Platten bei 4 × 10 4 . ausgesät Zellen/Well. Nach 12 h Kulturmedien mit frisch zubereitetem ALA-ES, Au-ES und A/A-ES (14 %, v /v ), wurden für 6 h durch das FBS-freie Medium ersetzt. Nach der Behandlung wurde HSF mit PBS gewaschen und 1 h in Kulturmedium inkubiert. Dann wurden sie mit einem He-Ne-Laser (632 nm Wellenlänge, 40 mW/cm 2 .) bestrahlt , Shanghai Institute of Laser Technology, China) mit 20 min. Dann wurde das Kulturmedium in Vorbereitung auf nachfolgende Experimente für weitere 24 h durch frisches DMEM mit 10 % FBS ersetzt. Darüber hinaus wurde mit A/A-ES und Bestrahlung behandeltes HSF vorfixiert, dehydriert und eingebettet, um Ultraschnitte für die TEM-Untersuchung vorzubereiten.
Intrazellulärer PpIX- und ROS-Generierungsassay
Die intrazelluläre PpIX-Akkumulation und die ROS-Erzeugung in HSF wurden unter Verwendung von konfokaler Laser-Scanning-Mikroskopie (CLSM, Leica TCS SP5, Deutschland) nachgewiesen. Der ROS-Generierungs-Assay wurde mit einem DCFH-DA durchgeführt und folgte den Anweisungen des Herstellers. Das Deckglas mit Zellen wurde auf einen Glasobjektträger montiert und bei 405 nm Anregung/635 nm Emission für PpIX und 488 nm Anregung/560 nm Emission für ROS beobachtet. Alle Daten wurden von der LAS AF-Software analysiert.
Apoptose- und Nekrose-Assay
Die Apoptose und Nekrose von HSF wurden mittels Durchflusszytometrie nach Doppelfärbung mit Annexin V-FITC und Propidiumiodid (PI) Doppelfärbung analysiert. Die Proben wurden gemäß dem Protokoll des Annexin V-FITC/PI-Apoptose-Nachweiskits hergestellt und dann von BD FACSCalibur (BD Biosciences, Mountain View, USA) analysiert. Die Datenanalyse wurde mit der Software FlowJo 7.6 durchgeführt.
Statistische Analyse
Die Daten wurden als Mittelwert ± SD dargestellt, sofern nicht anders angegeben. Die statistische Signifikanz wurde mit einem zweiseitigen Schülertest (P < 0,05) sofern nicht anders angegeben.
Abkürzungen
- A/A-ES:
-
5-Aminolävulinsäure/Au-Nanopartikel-beladenes ethosomales Vesikel
- ALA:
-
5-Aminolävulinsäure
- ALA-ES:
-
ALA-geladenes ES
- ALA-PDT:
-
ALA-basierte PDT
- Au-ES:
-
AuNP-geladenes ES
- AuNPs:
-
Au-Nanopartikel
- CLSM:
-
Konfokale Laser-Scanning-Mikroskopie
- DLS:
-
Dynamische Lichtstreuung
- DMEM:
-
Dulbecco’s Modified Eagle Medium
- EE:
-
Einfangeffizienz
- ES:
-
Ethosomale Vesikel
- FBS:
-
Fötales Rinderserum
- HS:
-
Hypertrophe Narbe
- HSF:
-
Hypertrophe Narbenfibroblasten
- ICP-MS:
-
Induktiv gekoppelte Plasma-Massenspektrometrie
- LSPR:
-
Lokalisierte Oberflächenplasmonenresonanz
- PDT:
-
Photodynamische Therapie
- PDT/PTT:
-
Photodynamische/photothermische Therapie
- PpIX:
-
Protoporphyrin IX
- PTT:
-
Photothermische Therapie
- ROS:
-
Reaktive Sauerstoffspezies
- SEM:
-
Rasterelektronenmikroskopie
- TEM:
-
Transmissionselektronenmikroskop
Nanomaterialien
- Nanopartikel für die Krebstherapie:Aktuelle Fortschritte und Herausforderungen
- BSA-beschichtete Gold-Nanostäbe für die photothermische NIR-II-Therapie
- Umweltverträgliche Metall-organische Gerüste als Wirkstoffabgabesystem für die Tumortherapie
- Ultrasensitiver Biosensor zum Nachweis von Vibrio cholerae-DNA mit Polystyrol-Co-Acrylsäure-Komposit-Nanosphären
- Neuartige biokompatible Au-Nanostars@PEG-Nanopartikel für die In-vivo-CT-Bildgebung und renale Clearance-Eigenschaften
- Synthese und In-vitro-Leistung von polypyrrolbeschichteten Eisen-Platin-Nanopartikeln für die Photothermie und die photoakustische Bildgebung
- 5-Aminolävulinsäure-Squalen-Nanoanordnungen für die Tumorphotodetektion und -therapie:In-vitro-Studien
- Antikörper-konjugierte Silica-modifizierte Goldnanostäbchen für die Diagnose und photothermische Therapie von Cryptococcus neoformans:ein In-vitro-Experiment
- Einfache Eintopf-Synthese von Polydopamin-Kohlenstoffpunkten für die photothermische Therapie
- Carbon Dots @ Platin-Porphyrin-Composite als theranostischer Nanowirkstoff für eine effiziente photodynamische Krebstherapie



