Lösungsmittelfreie katalytische Oxidation von Benzylalkohol an auf TiO2 abgeschiedenem Au-Pd-Bimetall:Vergleich von Rutil, Brookit und Anatas
Zusammenfassung
TiO2 (P25)-getragene Au-Pd-Bimetallnanopartikel zeigten eine hervorragende Leistung bei der lösemittelfreien katalytischen Oxidation von Benzylalkohol. Allerdings wurde den Auswirkungen von TiO2 . in der Forschung wenig Aufmerksamkeit geschenkt auf der katalytischen Aktivität von Au-Pd/TiO2 . In der vorliegenden Untersuchung werden Rutil, Brookit und Anatas TiO2 wurden erfolgreich synthetisiert und anschließend als Träger zum Beladen von Au-Pd-Nanopartikeln durch die Abscheidungs-Ausfällungs-Methode verwendet. Die experimentellen Ergebnisse zeigten, dass die Umwandlung von Benzylalkohol unter Verwendung des Rutil-TiO2 -getragener Au-Pd-Katalysator ist höher als die Umwandlung von Anatas und Brookit TiO2 -beladene Au-Pd-Katalysatoren. Allerdings ist das Au-Pd/TiO2 -Rutil zeigte die niedrigste bzw. höchste Selektivität gegenüber Benzaldehyd bzw. Toluol. Zur Charakterisierung dieser Katalysatoren wurden ICP-AES, XRD, XPS und TEM durchgeführt. Die entsprechenden experimentellen Ergebnisse zeigten, dass die hervorragende Leistung von Au-Pd/TiO2 -Rutil-Katalysator wurde sowohl der kleineren Au-Pd-Nanopartikelgrößenverteilung als auch den höheren Konzentrationen von Oα . zugeschrieben und Pd 2+ Spezies auf der Katalysatoroberfläche. In den Recyclingexperimenten wurde das Au-Pd/TiO2 -Rutil-Katalysator zeigte eine geringere Reaktionsstabilität im Vergleich zu Au-Pd/TiO2 -Anatas und Au-Pd/TiO2 -Brookit, was möglicherweise auf die Bedeckung der Oberfläche mit einer größeren Menge an Aldehydprodukten zurückzuführen ist.
Einführung
Gold galt lange als chemisch inert, bis Hutchings und Haruta unabhängig voneinander ihre hervorragenden katalytischen Aktivitäten bei der Acetylenhydrochlorierung bzw. bei der katalytischen Niedertemperatur-CO-Oxidation entdeckten [1, 2]. Gold als aktive Komponente wurde in vielen Reaktionen umfassend untersucht, einschließlich der Wassergas-Shift-Reaktion, der direkten Synthese von H2 O2 von O2 und H2 , und die selektive Hydrierung von Zimtaldehyd [3,4,5]. Außerdem konnte die Reaktivität und Stabilität von Au-basierten Katalysatoren durch deren Kombination mit Pd deutlich verbessert werden. Hutchings et al. fanden, dass die katalytische Aktivität von Au-Pd-Bimetall immobilisiert auf TiO2 (P25) ist viel höher als die von Au- oder Pd-Trägerkatalysatoren für die Benzylalkoholoxidation in Abwesenheit von Lösungsmitteln [6].
Es ist allgemein anerkannt, dass die katalytische Aktivität des getragenen Au-Pd-Bimetallkatalysators eng mit der Eigenschaft des Trägers, der Nanopartikelgröße und dem Herstellungsverfahren zusammenhängt. Als Katalysatorträger dienen reduzierbare Metalloxide wie TiO2 , CeO2 , und Fe2 O3 aufgrund der starken Wechselwirkung zwischen den Metallen und dem Träger, zusammen mit der leichten Aktivierung von molekularem Sauerstoff, weit verbreitet. TiO2 , als typischer Trägerkandidat, wurde intensiv als Träger von Au-Pd untersucht, was auch die herausragende katalytische Aktivität für die Benzylalkoholoxidation zeigte. Hutchings et al. stellten zunächst das Au-Pd/TiO2 . her nach der Sol-Immobilisierungsmethode und zur selektiven katalytischen Oxidation von Alkoholen zu Aldehyden eingesetzt. Die entsprechenden Ergebnisse zeigten, dass das Legieren von Au mit Pd zu einer bis zu fünfundzwanzigfachen Aktivitätssteigerung im Vergleich zum Au-Katalysator führen kann, während die Selektivität beibehalten wird [6]. Chadwicket al. stellten kürzlich das bimetallische Au-Pd/TiO2 . her Nanoröhren durch kolloidale Synthese und Immobilisierung auf natriumfreien Ti-Nanoröhren, die eine überlegene katalytische Leistung bei der Oxidation von Benzylalkohol zu Benzaldehyd zeigten [7]. Zhenget al. entwickelte eine Reihe von Au@Pd/TiO2 Katalysatoren mit hochdispersem Pd durch ein zweistufiges Photoabscheidungsverfahren, das auch als hochaktiver Katalysator für die aerobe Oxidation von Benzylalkohol unter lösungsmittelfreien Bedingungen fungierte [8]. Liet al. bioreduktiver Ansatz mit Cacumen-Platycladi-Extrakt zur Herstellung von Au-Pd/TiO2 und dann in eine lösungsmittelfreie Oxidation von Benzylalkohol angewendet. Der Katalysator zeigte eine ausgezeichnete katalytische Leistung, Haltbarkeit und Wiederverwendbarkeit [9].
Die am häufigsten verwendete Art von TiO2 ist P25. Es ist jedoch bekannt, dass Titandioxid drei verschiedene Formen enthält:Rutil, Brookit und Anatas. Bisher konnte festgestellt werden, dass der Einfluss von TiO2 Form auf die katalytische Aktivität wurde nur bei photokatalytischen Reaktionen und katalytischen Gas-Feststoff-Oxidationsreaktionen wie CO2 . berichtet photokatalytische Reduktion, katalytische CO-Oxidation und NH3 selektive katalytische Reduktion NOx [10,11,12]. Es ist allgemein anerkannt, dass Anatas TiO2 , als Träger, zeigt normalerweise eine bessere katalytische Aktivität als die von Rutil und Brookit TiO2 . Dennoch steht diese Sichtweise im Widerspruch zu einigen experimentellen Ergebnissen. Dai et al. verwendete Abscheidungs-Ausfällungs-Methode, um Au auf die Oberfläche von Anatas, Rutil, Brookit TiO2 . zu laden , bzw. P25 und untersuchten ihre katalytische Aktivität für die CO-Oxidation. Die entsprechenden Ergebnisse legten nahe, dass der Brookit TiO2 -getragener Goldkatalysator weist aufgrund der kleineren Au-Nanopartikel auf der Oberfläche die höchste katalytische Aktivität auf [11]. Yaoet al. vorbereitetes CeO2 /Anatas, CeO2 /brookit und CeO2 /rutile mit der traditionellen Imprägniermethode mit beginnender Nässe und verglichen deren NH3 -SCR-Katalysatorleistung. Die experimentellen Ergebnisse zeigten, dass die optimale katalytische Leistung mit dem CeO2 . erzielt werden konnte /Rutil, was an seiner hervorragenden Redoxleistung, einer höheren Konzentration an sauren Zentren, Ce 3+ . liegen könnte Spezies und adsorbierte Sauerstoffspezies auf der Katalysatoroberfläche [12]. Liet al. untersuchte das CO2 Photoreduktion mit Wasserdampf über Rutil, Anatas und Brookit TiO2; Die experimentellen Ergebnisse zeigten, dass Brookit TiO2 zeigten die bessere photokatalytische Leistung im Vergleich zu Anatas und Rutil, was mit der niedrigsten Bildungsenergiebarriere von Sauerstoffleerstellen auf der Brookitoberfläche zusammenhängt [10].
Obwohl Au-Pd/TiO2 Katalysator hat die herausragende katalytische Aktivität bei der Benzylalkoholoxidation gezeigt, der Einfluss des TiO2 -gestützte Au-Pd-Form auf die katalytische Leistung wurde bisher nicht untersucht. Daher ist es wichtig, vergleichende Experimente durchzuführen, um die Unterschiede in der katalytischen Aktivität zu untersuchen und die Gründe für die unterschiedliche katalytische Leistung von TiO2 . aufzudecken -unterstütztes Au-Pd auf Rutil, Brookit und Anatas TiO2 . Die vorliegende Arbeit untersuchte die katalytische Aktivität der Benzylalkoholoxidation an Bimetall-Au-Pd-Trägern auf Anatas, Rutil bzw. Brookit. In der Zwischenzeit wurden XRD, ICP-AES, XPS und TEM angewendet, um die Wirkung von TiO2 . aufzudecken Form über die physikalisch-chemischen Eigenschaften von Au-Pd/TiO2 .
Methoden
Alle chemischen Reagenzien wurden von Aladdin Company (Shanghai China) bezogen und wie erhalten verwendet:Harnstoff (99,9 % Metallbasis), wässrige Titanbis(ammoniumlactat)dihydroxidlösung (TBD, 50 % in Wasser), TiCl4 (99,99 % auf Metallbasis), Ethanol (≥ 99,5%, Reinheit), H2 SO4 (> 98%, Reinheit), PdCl2 (99,99 % Metallbasis), HAuCl4 ·3H2 O (≥ 99,9 % auf Spurenmetallbasis), Benzylalkohol (99,8 %, Reinheit). O2 (99,999 %, Reinheit) wurde von der Taiyuan Iron and Steel Corporation geliefert.
Synthese von Brookit und Anatas TiO2 [13]
Zur Vorbereitung des Brookiten TiO2 , 8 ml TBD-Lösung (50 %) und 17 µg Harnstoff wurden zuerst gemischt, dann wurde die Mischlösung durch Zugabe von zusätzlichem entionisiertem Wasser auf 80 ml eingestellt. Anschließend wurde die resultierende Lösung in einen 200-ml-Autoklaven mit Teflonauskleidung überführt, der eingekapselt und 24 h bei 160 °C gehalten wurde. Als der Autoklav auf Raumtemperatur abgekühlt war, wurden die Niederschläge abfiltriert, gewaschen und getrocknet. Schließlich wurde das erhaltene Pulver bei 500 °C für 5 h kalziniert.
Zur Herstellung von Anatas TiO2 , wir haben nur die Harnstoffdosis von 17 auf 0,48 g angepasst und die oben angegebenen Schritte wiederholt.
Synthese von Rutil-TiO2 [10]
Für das Rutil-TiO2 , die erforderliche Menge an TiCl4 wurde unter Rühren in Ethanol gelöst. Nachdem sich das gelbliche Sol gebildet hatte, wurde Wasser tropfenweise unter Rühren in die obige Lösung gegeben. Das Molverhältnis von TiCl4 , Ethanol und Wasser wurde auf 2:20:280 eingestellt. Die resultierende Mischung wurde weitere 3 h gerührt und 24 h bei 50 °C in einem gut verschlossenen Autoklaven gealtert. Anschließend wurde der weiße Niederschlag zentrifugiert, gewaschen und getrocknet. Schließlich wurde das erhaltene Produkt auch bei 500 °C für 5 h kalziniert.
Vorbereitung von Au-Pd-Ablagerungen auf Brookite, Anatas und Rutil
Um das Au:Pd-Molverhältnis von 1:1 zu halten, müssen die nominalen Beladungen von Au und Pd auf dem Au-Pd/TiO2 Katalysatoren betrugen 1,00 Gew.-% bzw. 0,54 Gew.-%. 1,00 Gew.-% Au-0,54 Gew.-% Pd/TiO2 (Brookit, Anatas und Rutil) wurden durch das Abscheidungs-Fällungsverfahren mit Harnstoff als Fällungsmittel hergestellt. Typischerweise zur Herstellung von Au-Pd/TiO2 -Brookit, 2 mL wässrige Lösung von HAuCl4 (5 mg Au/ml), 1,08 ml wässrige Lösung von PdCl2 (5 mg Pd/ml), 0,985 g Brookit TiO2 und 3,48 µg Harnstoff wurden in 100 µl entionisiertem Wasser unter Rühren bei Raumtemperatur zugegeben. Die Mischungslösung wurde 6 h bei 80 °C gerührt. Dann wurde die erhaltene Lösung weitere 12 h bei Raumtemperatur gealtert. Anschließend wurde der Niederschlag zentrifugiert, gewaschen und getrocknet. Schließlich wurde das erhaltene Produkt bei 300 °C für 2 h mit einer Heizrate von 2 °C/min kalziniert.
Der Einfachheit halber wird das vorbereitete TiO2 -Brookit, TiO2 -Rutil, TiO2 -Anatas-Katalysatoren Au-Pd/TiO2 -Brookit, Au-Pd/TiO2 -Rutil und Au-Pd/TiO2 -Anatas-Proben wurden als TiO2 . bezeichnet -B, TiO2 -R, TiO2 -A, ATB, ATR bzw. ATA.
Benzylalkoholoxidation
Die katalytische Oxidation von Benzylalkohol wurde in einem mechanisch gerührten Reaktor unter Verwendung von mit Glas ausgekleideten 50-ml-Min-Klavs (Anhui Kemi Machinery Technology Co., Ltd, China) durchgeführt. Typischerweise wurden 15 µl Benzylalkohol und 0,05 µg Katalysator in den Reaktor eingeführt, und der Reaktor wurde verschlossen und fünfmal mit O2 gespült . Anschließend wurde der Reaktor mit O2 . auf 0,3 MPa unter Druck gesetzt bei Raumtemperatur. Die Reaktionsmischung wurde bei 1000 U/min auf die erforderliche Temperatur erhitzt. Der Reaktor war auch mit dem Sauerstoffreservoir verbunden, um den während der Reaktion verbrauchten Sauerstoff nachzufüllen. Die Reaktionsprodukte wurden durch GC (FuLi GC9790, Zhejiang, China) analysiert, ausgestattet mit einem Flammenionisationsdetektor (FID) und einer DM-5-Säule (30 µm x 0,25 µm x 0,25 µm). Um die Zuverlässigkeit der Daten zu gewährleisten, wurde jede Versuchsgruppe mindestens zweimal wiederholt und jeder Datenpunkt dreimal durch GC bestimmt.
Um die Stabilität der katalytischen Aktivität zu untersuchen, wurde der wiederverwendete Katalysator in drei Katalysekreisen durchgeführt. Nach jedem Durchlauf wurde der Katalysator gesammelt und mit Aceton gewaschen und dann 16 Stunden lang auf 80 °C erhitzt.
Charakterisierung
Pulver-XRD wurde auf einem Rigaku D/max-RC-Diffraktometer mit CuKα-Strahlung bei 40 kV und 25 mA (λ =0,15418 nm). Die Intensitäten wurden im Scanbereich von 10–90° bei einer Geschwindigkeit von 8°/min aufgenommen. ICP-AES wurde durchgeführt, um die chemische Zusammensetzung der hergestellten Katalysatoren auf einem Agilent 735-ES-Gerät quantitativ zu bestimmen. Vor den Messungen wurde der Katalysator ca. 24 h in Königswasser gelöst. Röntgenphotoelektronenspektroskopie-Messungen wurden auf einem PHI-1600ESCA System XPS-Spektrometer (Perkin-Elmer, USA) unter Verwendung von nicht-monochromatischer Mg-Kα-Strahlung durchgeführt, die bei 15 kV und unter 10 -7 . betrieben wurde Pa-Druck mit auf 1254 eV eingestellter Photoelektronenenergie. Die angegebenen Bindungsenergien wurden auf die C1s-Bindungsenergie von 284.6 eV bezogen. TEM wurde an einem JEM-2100-Elektronenmikroskop durchgeführt, das bei 200 kV betrieben wurde. Vor der Analyse wurden die Probenpulver mit Hilfe von Ultraschall mit Ethanol dispergiert und dann die gemischte Lösung auf ein Gitternetz mit Kohlefilm aufgetragen.
Ergebnisse und Diskussion
XRD wurde durchgeführt, um die Kristallform von TiO2 . zu untersuchen Ladungsträger und die Au-Pd-Dispersionszustände auf dem Au-Pd/TiO2 Katalysatoren. Wie in Abb. 1 gezeigt, wurden zehn Beugungspeaks bei 25,4, 37,8, 48,1, 54,1, 55,2, 62,9, 68,8, 70,4, 75,1 und 82,7° für das präparierte Anatas-TiO2 . nachgewiesen , die mit der Standard-PDF-Karte (Nr. 21-1272) übereinstimmten. Es konnte auch festgestellt werden, dass eine Reihe von Peaks bei 25,4, 30,9, 32,8, 36,3, 37,4, 40,2, 42,4, 46,2, 48,2, 49,3, 54,4, 55,3, 57,4, 60,2, 62,2, 63,8, 65,1, 66,1, 69,1, 70,7 , 77,2, 82,7 und 87,0° wurden auf dem präparierten Brookit TiO2 . nachgewiesen Träger, die gut zur Standard-Brookite-PDF-Karte passen (brookite TiO2 PDF-29-1360). Das vorbereitete Rutil-TiO2 zeigten die entsprechenden Peaks bei 27,5, 36,1, 39,2, 41,3, 44,2, 54,3, 56,6, 62,7, 64,1, 69,1, 69,9, 76,6, 82,4 und 84,3°, was auch mit dem Rutil-TiO2 PDF-Karte (Rutil-TiO2 PDF 21-1276). Die obigen XRD-Ergebnisse bestätigten, dass TiO2 mit Rutil-, Brookit- und Anatas-Formen wurden erfolgreich hergestellt. Inzwischen ist das durchschnittliche TiO2 Kristallitgrößen wurden mithilfe der Scherrer-Gleichung basierend auf den Informationen der Beugungspeaks an verschiedenen Orten (2θ =25,4° für TiO2 -A, 30,9° für TiO2 -B und 27,6° für TiO2 -R); die berechneten Ergebnisse zeigten, dass die Nanopartikelgrößen von TiO2 wurden in folgender Reihenfolge angeordnet:TiO2 -R (27,6 nm)> TiO2 -B (18,9 nm)> TiO2 -A (11,2 nm). Nach Beladung der Oberflächen von TiO2 . mit Au-Pd-Bimetall-Nanopartikeln Ladungsträgern wurden auf dem präparierten Au-Pd/TiO2 . keine Beugungspeaks festgestellt, die Au oder Pd zugeordnet wurden Muster. Dieses Phänomen deutete nicht nur darauf hin, dass Au und Pd hochgradig in kleineren Partikelgrößen (z Ladungsträger blieb von der Beladung mit Au und Pd unberührt.
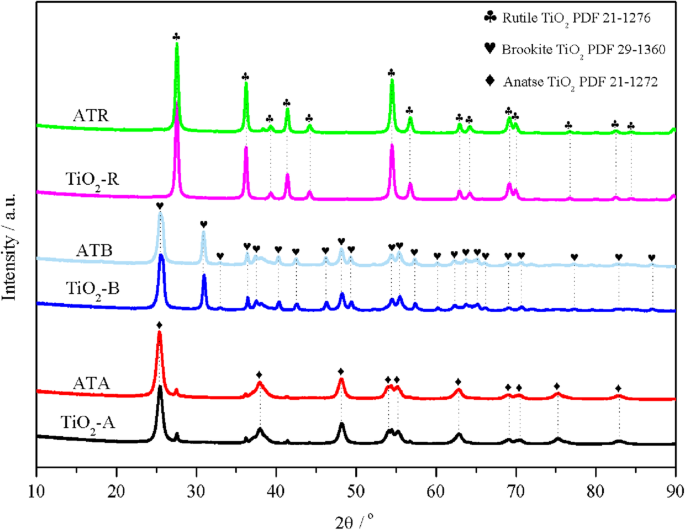
XRD-Muster des TiO2 -A, ATA, TiO2 -B, ATB, TiO2 -R- und ATR-Samples
Zur Bestimmung des tatsächlichen Gehalts an Au und Pd auf dem präparierten Au-Pd/TiO2 Katalysatoren wurde die ICP-AES durchgeführt. Die entsprechenden Ergebnisse sind in Tabelle 1 aufgeführt. Es wurde festgestellt, dass die tatsächlichen Metallkonzentrationen unter den Nennwerten lagen, was möglicherweise auf das Auslaugen schwach adsorbierter Au-Pd-Nanopartikel während des Filtrations- oder Waschprozesses zurückzuführen ist.
XPS wurde als oberflächenempfindliche Sondentechnik durchgeführt, um die Zusammensetzung der Oberflächenelemente und die chemischen Zustände zu detektieren. Abbildung 2 zeigt die Spektren von Au (4f), Pd (3d), O (1 s) und Ti (2p) für die auf TiO2 . aufgebrachten Au-Pd-Nanopartikel Katalysatoren. Wie in Abb. 2.1 gezeigt, wurden Au 4f-Spektren an zwei Stellen auf jedem Katalysator nachgewiesen, aber die spezifischen Positionen der beiden Peaks waren leicht unterschiedlich. Es ist allgemein anerkannt, dass das Au 4f-Spektrum im metallischen Zustand normalerweise zwei Beiträge (4f7/2 und Au 4f5/2 ), die bei 84,0 bzw. 87,7 eV lokalisiert waren [14]. Die beobachtete negative Verschiebung der Au 4f-Spektren für diese drei Au-Pd/TiO2 Katalysatoren könnten durch die elektronische Modifikation von Au-Spezies durch Pd-Spezies erklärt werden, was auch auf die starke Wechselwirkung zwischen Au- und Pd-Spezies schließen lässt. Darüber hinaus wurden auf dem präparierten Au-Pd/TiO2 . keine ionischen Au-Spezies nachgewiesen Katalysatoren.
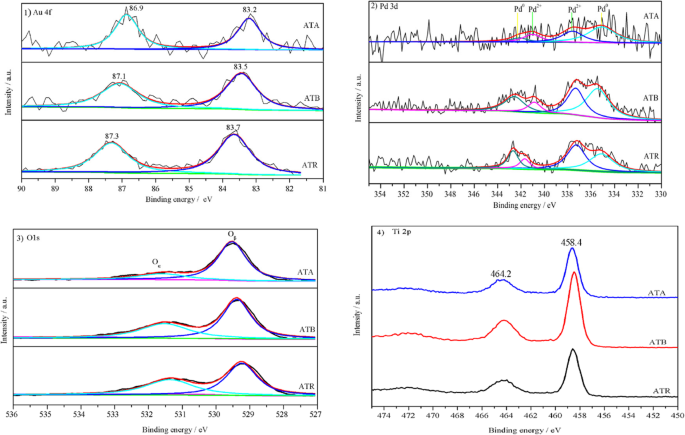
XPS-Spektren von (1 ) Au 4f , (2 )Pd 3d, (3 ) O1s und (4 ) Ti 2p) für die ATA-, ATB- und ATR-Proben
Abbildung 2.2 zeigt die XPS-Spektren der Pd-3d-Kernregionen der ATA-, ATB- und ATR-Proben. Nach früheren Berichten konnten die Bänder von Pd 3d in vier Unterpeaks entfaltet werden; das Pd 3d3/2 und 3d5/2 Peaks bei etwa 335 und 341 eV werden dem metallischen Pd 0 . zugeschrieben [15], das Pd 3d5/2 und 3d7/2 zentriert bei etwa 337 und 342 eV werden dem Pd 2+ . zugeschrieben [16]. Offensichtlich Pd 0 und Pd 2+ auf der Katalysatoroberfläche koexistierten, basierend auf den Analyseergebnissen. Die Prozentsätze von Pd 2+ Spezies auf Au-Pd/TiO2 Katalysatoren wurden durch XPS-Anpassungsflächen Pd 2+ . erhalten /(Pd 2+ +Pd 0 ). Der Inhalt von Pd 2+ auf der Katalysatoroberfläche waren in folgender Reihenfolge angeordnet:ATR (55,4%)> ATB (48,2%)> ATA (34,8%). Es ist allgemein anerkannt, dass die Bildung von Pd 2+ Spezies auf der Katalysatoroberfläche ist eng mit den Trocknungs- und Kalzinierungsvorgängen verbunden [17]. Dennoch sind die höheren Verhältnisse von Pd 2+ auf der ATR und ATB zeigte, dass das TiO2 Träger spielte auch eine wesentliche Rolle bei der Förderung der Bildung von Pd 2+ , das Sauerstoff liefern könnte, um die Produktion von Pd 2+ . zu unterstützen . Die Existenz von Pd 2+ Spezies zeigt ferner, dass einiges Pd nicht mit Au legieren kann; dieses Phänomen wurde in ähnlichen Au-Pd/CeO2 . berichtet Katalysator [18].
Die XPS-Spektren von O1s an den ATA-, ATB- und ATR-Katalysatoren sind in Abb. 2.3 dargestellt. Wie berichtet, kann der O1s-Peak in zwei Sub-Peaks eingepasst werden. Das Teilband bei der unteren Bandenenergie (529.1 eV) kann dem Gittersauerstoff (Oβ ) und die Teilbande bei der höheren Bindungsenergie (531,0 eV) kann dem oberflächenadsorbierten Sauerstoff (Oα ). Bei den traditionellen katalytischen Oxidationsreaktionen zeigt der an der Oberfläche adsorbierte Sauerstoff aufgrund seiner höheren Mobilität normalerweise eine höhere Reaktivität als Gittersauerstoff [19]. Daher ist das Oα Verhältnisse auf diesen drei Au-Pd/TiO2 Katalysatoren wurden durch XPS-Anpassungsflächen Oα . berechnet /(Oα +Oβ ). Es wurde festgestellt, dass die Oα Verhältnis auf der ATR (43,8%) ist höher als die Oα Verhältnis auf ATB (38,7%) und ATA (20,2%). Die Oα Das Verhältnis kann auch verwendet werden, um den Gehalt an Sauerstoffleerstellen auf der Katalysatoroberfläche abzuschätzen, die eine Schlüsselrolle bei der Stabilisierung der Au-Pd-Nanopartikel auf dem Katalysator und der Förderung der katalytischen Aktivität spielen. Die Oα Verhältnisse stimmen mit Pd 2+ . überein Konzentrationen auf der Katalysatoroberfläche. Abbildung 2.4 zeigt die Ti2p XPS-Spektren. Die Peaks sind bei etwa 464,2 und 458,4 eV zentriert; dies könnte dem Ti 2p1/2 . zugeschrieben werden und Ti 2p3/2 von Ti 4+ in TiO2 , was darauf hinweist, dass sich Ti in der Oxidationsstufe +4 [20] befand.
Die aus den XPS-Charakterisierungsergebnissen erhaltenen Oberflächenatomkonzentrationen sind in Tabelle 2 zusammengefaßt sub>2 Katalysatoren ist niedriger als in der entsprechenden Masse. Die Konzentrationen von Pd auf der Katalysatoroberfläche zeigten ebenfalls einen ähnlichen Trend, mit Ausnahme von Pd auf der ATR. Basierend auf den ermittelten Au- und Pd-Konzentrationen auf der Katalysatoroberfläche wurden die molaren Verhältnisse von Au/Pd berechnet und nach ATA> ATB> ATR geordnet. Diese Werte waren niedriger als die Nominal- und Bulk-Au/Pd-Werte, was darauf hindeutet, dass die Wechselwirkung zwischen Metallnanopartikeln und TiO2 ist eng mit den Trägerformularen verbunden.
TEM wurde durchgeführt, um die Morphologie der Katalysatoren und die Größenverteilungen von Au-Pd-Nanopartikeln auf der Katalysatoroberfläche zu untersuchen. Die entsprechenden TEM-Bilder und Histogramme der Au-Pd-Verteilungen sind in Abb. 3 dargestellt. Bemerkenswert ist, dass mehr als 100 Nanopartikel gemessen wurden, um die durchschnittliche Partikelgröße zu berechnen. Wie in Abb. 3a gezeigt, konnte das am ATA-Katalysator beobachtete Phänomen der Trägeragglomeration und die Größenverteilung der Au-Pd-Nanopartikel unter Verwendung einer lognormalen Verteilung mit einer mittleren Größe von ungefähr 4,6 nm beschrieben werden. Inzwischen wurde festgestellt, dass Brookit TiO2 präsentierten eine stäbchenförmige Form und die durchschnittliche Au-Pd-Nanopartikelgröße auf dem ATB war kleiner als die Nanopartikelgröße auf ATA. Dieses Ergebnis stimmte mit dem Bericht von Dai überein [11]. Für den ATR-Katalysator wurde die gleichmäßigste Dispersion von Au-Pd-Nanopartikeln auf der Katalysatoroberfläche und die kleinste durchschnittliche Partikelgröße (4,1 nm) erhalten. Die TEM-Ergebnisse zeigten, dass die mittlere Partikelgröße und die Partikelgrößenverteilung stark von den Eigenschaften und Formen des Katalysatorträgers abhängt.
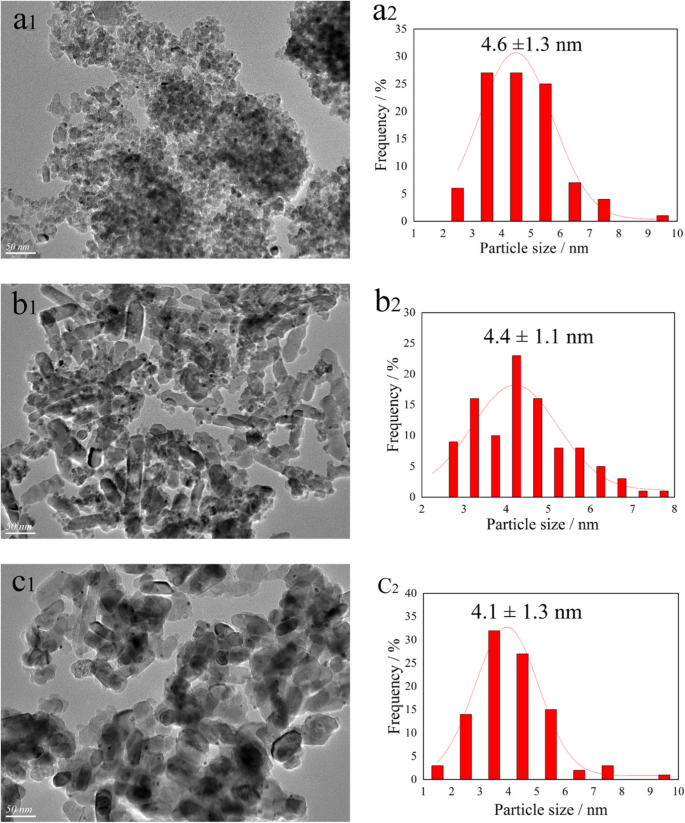
TEM-Bilder und Histogramme der Au-Pd-Partikelgrößenverteilung des ATA (a 1 , a 2 ), ATB (b 1 , b 2 ) und ATR (c 1 , c 2 ) Katalysatoren
Katalytische Aktivitätsmessung
Au-Pd-Nanopartikel auf verschiedenen Formen von TiO2 wurden für die Benzylalkoholoxidation mit 0.3 MPa reinem Sauerstoff bei 120 °C unter lösungsmittelfreien Bedingungen untersucht. Die entsprechenden Ergebnisse sind in Abb. 4 dargestellt. Wie aus der Abbildung ersichtlich, erreichte der Benzylalkoholumsatz am ATR-Katalysator nach 3 h Reaktionszeit ca. 65,11 %. Jedoch konnten unter den gleichen Bedingungen nur 60,01 % und 51,75 % Benzylalkoholumwandlungen an den ATB- und ATA-Katalysatoren erhalten werden. Außerdem zeigte sich, dass der Benzylalkoholumsatz über den Untersuchungszeitraum in folgender Reihenfolge angeordnet werden konnte:ATR> ATB> ATA. Anhand der XPS-Charakterisierungsergebnisse können wir feststellen, dass Oα und Pd 2+ wiesen auch ähnliche Trends auf, was darauf hindeutet, dass die Oα und Pd 2+ Verhältnisse spielen eine Schlüsselrolle bei der Bestimmung der katalytischen Leistung. Darüber hinaus legten die TEM-Ergebnisse nahe, dass die kleinere Au-Pd-Partikelgröße auf dem ATR erhalten wurde, was auch für die Förderung der katalytischen Aktivität hilfreich ist. Wie wir alle wissen, sind die Hauptprodukte der Benzylalkohol-Oxidationsreaktion Benzaldehyd und Toluol, und die verbleibenden Nebenprodukte umfassen Benzol, Benzoesäure und Benzylbenzoat. Alle diese Produkte wurden während unserer Experimente nachgewiesen und der typische Fall ist in Tabelle 3 aufgeführt, was mit den veröffentlichten Literaturstellen zur Benzylalkoholoxidation an immobilisierten Au-Pd-Katalysatoren übereinstimmt [21, 22]. Inzwischen konnte festgestellt werden, dass der ATR-Katalysator während des gesamten Reaktionsprozesses eine höhere Selektivität für Toluol und eine geringere Selektivität für Benzaldehyd im Vergleich zu ATA- und ATB-Katalysatoren aufwies (Abb. 5).
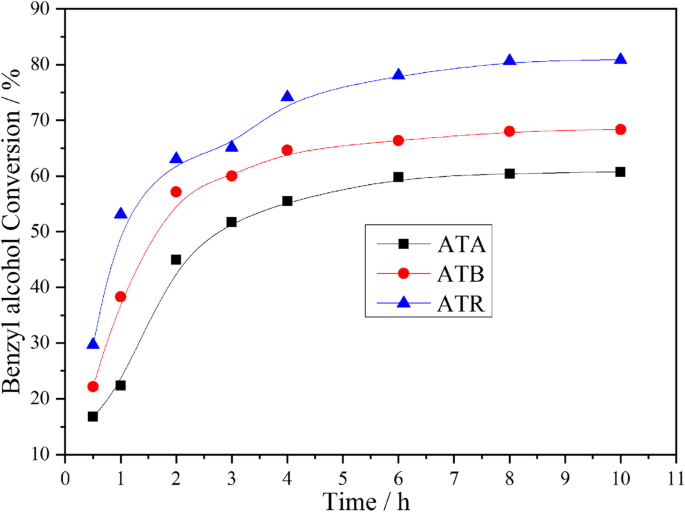
Benzylalkoholumwandlung als Funktion der Zeit, die bei ATA, ATB und ATR erreicht wird
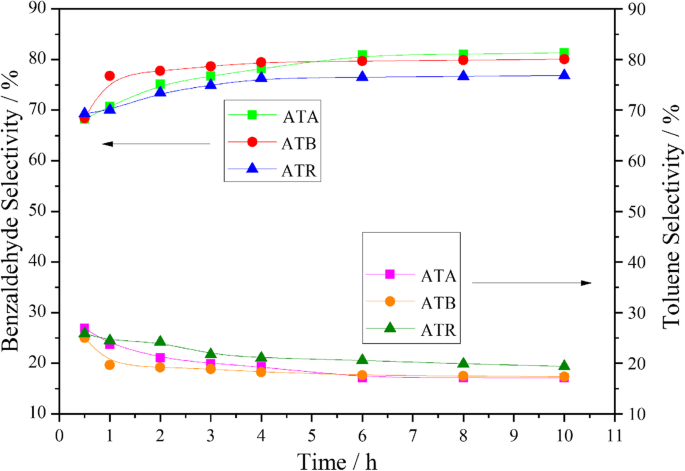
Benzaldehyd- und Toluol-Selektivitäten als Funktion der Zeit, erhalten auf ATA, ATB und ATR
Um die Stabilität von Au-Pd/TiO2 . weiter zu untersuchen Katalysatoren bei der Benzylalkoholoxidation wurde die katalytische Leistung der ATA-, ATB- und ATR-Katalysatoren bei wiederholtem Einsatz untersucht. Die entsprechenden Ergebnisse sind in Fig. 6 dargestellt. Nach jeder Aktivitätsbewertung wurde der Katalysator durch Zentrifugieren von der Mischlösung abgetrennt, dann mit Aceton gewaschen und 16 h auf 80 °C erhitzt. Es wurde festgestellt, dass die ATA- und ATB-Proben im Vergleich zur ATR-Probe eine höhere katalytische Stabilität aufwiesen. Die Benzylalkoholumwandlung im 1., 2. und 3. Kreislauf betrug 51,28 %, 51,06 % bzw. 51,49 % für den ATA-Katalysator und 59,78 %, 59,54 % bzw. 58,76 % für die ATB-Probe. Die Benzylalkoholumwandlung gegenüber der ATR-Probe zeigte jedoch nach jedem Zyklus einen signifikanten Rückgang; die katalytische Aktivität nahm von den anfänglichen 65,11 % auf die letzten 59,22 % ab, was möglicherweise auf eine Pd-Vergiftung zurückzuführen ist. Das Pd wurde vergiftet, wenn der Katalysator während der Reaktion mit den Produkten gesättigt war. Es wird allgemein berichtet, dass Katalysatoren auf Pd-Basis aufgrund des Desorptionsproblems von Aldehydprodukten auf der Katalysatoroberfläche leicht desaktiviert werden [22,23,24,25]. In unserem Fall wurde bei XPS-Messungen festgestellt, dass ATR die höchste Pd-Konzentration (0,65 Atom-%) auf der Katalysatoroberfläche enthält.
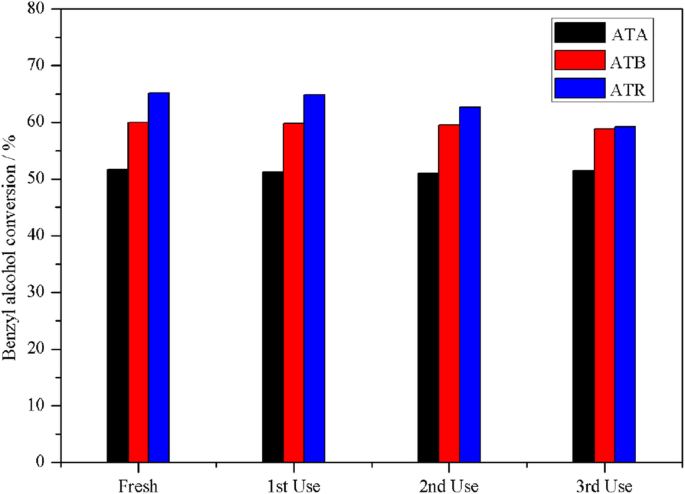
Die Wiederverwendung der ATA-, ATB- und ATR-Katalysatoren bei der Benzylalkohol-Oxidation unter lösemittelfreien
Schlussfolgerung
Zusammenfassend wurden Au-Pd-Nanopartikel mit einem Molverhältnis von 1:1 auf den verschiedenen Formen von TiO2 . abgeschieden durch das Abscheidungs-Ausfällungsverfahren. Als Sondenreaktion wurde die Benzylalkoholoxidation gewählt, um die katalytische Aktivität in Abwesenheit von Lösungsmitteln zu untersuchen. Basierend auf den Ergebnissen der Charakterisierung und Aktivitätsbewertung konnte festgestellt werden, dass die katalytische Aktivität von Au-Pd/TiO2 Katalysator war fest mit dem TiO2 . verwandt bilden. Charakterisierungsergebnisse von XPS und TEM deuteten darauf hin, dass die ATR-Oberfläche größeres Oα . enthielt und Pd 2+ Konzentrationen zusammen mit der kleineren Au-Pd-Nanopartikelgröße im Vergleich zu ATB- und ATA-Katalysatoren, die eine entscheidende Rolle bei der Erzielung des hohen Benzylalkoholumsatzes spielten. Der ATR-Katalysator zeigte jedoch im Vergleich zu den ATA- und ATB-Katalysatoren eine geringere katalytische Stabilität, was mit der Bedeckung der Oberfläche mit einer größeren Menge an Aldehydprodukten während des Reaktionsprozesses zusammenhängen könnte.
Verfügbarkeit von Daten und Materialien
Alle Daten sind uneingeschränkt verfügbar.
Abkürzungen
- ATA:
-
Au-Pd/TiO2 -Anatas
- ATB:
-
Au-Pd/TiO2 -brookite
- ATR:
-
Au-Pd/TiO2 -Rutil
- FID:
-
Flammenionisationsdetektor
- GC:
-
Gaschromatographie
- ICP-AES:
-
Atomemissionsspektrometrie mit induktiv gekoppeltem Plasma
- TBD:
-
Titan bis (Ammoniumlactat) Dihydroxid
- TEM:
-
Transmissionselektronenmikroskop
- TiO2 -A:
-
TiO2 -Anatas
- TiO2 -B:
-
TiO2 -brookite
- TiO2 -R:
-
TiO2 -Rutil
- XPS:
-
Röntgenphotoelektronenspektroskopie
- XRD:
-
Röntgenpulverbeugung
Nanomaterialien
- Auf dem Weg zu TiO2-Nanofluiden – Teil 1:Vorbereitung und Eigenschaften
- Einstufige Elektrospinnroute von SrTiO3-modifizierten Rutil-TiO2-Nanofasern und ihre photokatalytischen Eigenschaften
- Herstellung und verbesserte katalytische Hydrierungsaktivität von Sb/Palygorskit (PAL)-Nanopartikeln
- Auf dem Weg zu TiO2-Nanofluiden – Teil 2:Anwendungen und Herausforderungen
- Auswirkung der Verteilung von Goldnanopartikeln in TiO2 auf die optischen und elektrischen Eigenschaften von farbstoffsensibilisierten Solarzellen
- Vergleich von gemusterten Metallelektroden vom Nanoloch-Typ und vom Nanosäulen-Typ, die in organischen Solarzellen eingebaut sind
- Strukturelle und im sichtbaren Infrarotbereich sichtbare optische Eigenschaften von Cr-dotiertem TiO2 für farbige kühle Pigmente
- TiO2-Nanoröhren-Arrays:Hergestellt durch weiche-harte Schablone und die Korngrößenabhängigkeit der Feldemissionsleistung
- Bestimmung der katalytischen Aktivität von Übergangsmetall-dotierten TiO2-Nanopartikeln mittels spektroskopischer Oberflächenanalyse
- Honen und Läppen im Vergleich



